.jpg)
- Прием в клинике, выезд на дом и дистанционные консультации по E-mail и WhatsAp
- УЗИ сердца собакам и кошкам в клинике и с выездом на дом на аппарате высокого класса
Veterinary Clinics of North America: Small Animal Practice
May 2017
Перевод с англ.: ветеринар - невролог/кардиолог Васильев
Ключевые моменты
- Клиницисты должны знать, что признаки печеночной энцефалопатии у собак и кошек могут быть едва заметными и периодическими.
- Аммиак – не единственный фактор, вызывающий печеночную энцефалопатию; имеются убедительные доказательства того, что воспаление также играет ключевую роль. Знание этих других факторов и предрасполагающих факторов улучшает ведение таких случаев.
- Ограничение потребления белка в рационе больше не является краеугольным камнем в лечении печеночной энцефалопатии.
Введение
Гепатоэнцефалопатия наиболее часто определяется в ветеринарии как неврологическая дисфункция, вызванная заболеванием печени и/или портосистемным шунтированием. Это определение учитывает различные последствия заболевания печени для центральной нервной системы, которые необходимо охватить. В медицине человека определены широкие категории заболеваний печени, приводящих к печеночной энцефалопатии, и они применимы в ветеринарии (таблица 1). В ветеринарии, хотя острая гепатопатия встречается нередко, из-за резервных возможностей печени острая печеночная недостаточность (категория А) является относительно редкой причиной печеночной энцефалопатии у собак и кошек. Категория В является наиболее распространенной причиной печеночной энцефалопатии, наблюдаемой в ветеринарной практике, из-за высокой распространенности врожденных портосистемных шунтов. Для животных-компаньонов было предложено расширить категорию С, включив в нее все хронические заболевания печени, а не только конечную стадию цирроза.
Клинические симптомы
Спектр клинических симптомов варьирует от едва заметных отклонений в поведении до комы. При гепатоэнцефалопатии могут возникать судорожные припадки, хотя они обычно встречаются в сочетании с несколькими симптомами, а не изолированно. Шкала оценок тяжести заболевания для людей модифицирована для ветеринарных пациентов (таблица 2). В медицине для людей используется более тонкая оценка: минимальная печеночная энцефалопатия, при которой люди кажутся неврологически нормальными, но при психометрическом тестировании выявляются когнитивные нарушения.
Было высказано предположение, что человеческая шкала будет пересмотрена, объединив нулевую и первую степень отчасти из-за субъективности в точном определении первой степени. Они будут объединены в “скрытую печеночную энцефалопатию ” и II-IV степени, называемую “явной печеночной энцефалопатий ”. Маловероятно, что, имеет смысл определения нулевой степени у собак и кошек. Однако, вероятно, что определение I степени в ветеринарной медицине страдает повышенной субъективностью; в рамках консультации снижение умственной активности является относительным понятием, а сопутствующие заболевания (например, дегенеративное заболевание суставов у собаки с хроническим гепатитом) могут способствовать апатии. Следовательно, возможно, что животные I степени могут быть классифицированы как бессимптомные и наоборот. Клинические признаки печеночной энцефалопатии часто усиливаются и ослабевают, при этом животные переходят от симптоматического к асимптомному течению.
Хроническиая печеночная энцефалопатия может быть подразделена на постоянную или эпизодическую (см. таблицу 1). Поскольку клинические признаки могут быть малозаметными и проявляться эпизодически, врачам следует поддерживать высокий уровень подозрительности у животных, подверженных риску печеночной энцефалопатии. Нераспознанная печеночная энцефалопатия может способствовать заболеваемости и, в конечном счете, смертности из-за снижения качества жизни. Владельцы часто, на удивление, не замечают, когда у их животного проявляются явные отклонения в поведении, как у молодых животных с врожденными портосистемными шунтами, так и у пожилых животных с приобретенными шунтами. Обучение владельцев помогает справиться с этим заболеванием, особенно в случаях эпизодической печеночной энцефалопатии.
Таблица 1
Категория патологического процесса печени, приводящего к печеночной энцефалопатии, с рекомендуемой ветеринарной модификацией
|
Тип печеночной энцефалопатии |
|
Подкатегория |
Подраздел |
Ветеринарная модификация |
|
А |
Острая печеночная недостаточность |
|
|
|
|
В |
Портосистемное шунтирование без характерных гепатоцеллюлярных заболеваний |
|
|
|
|
С |
Цирроз печени и портальная гипертензия или портосистемные шунты |
Эпизодическое Постоянное Минимальное |
Спонтанное Рецидивирующее Слабовыраженное Тяжелое |
Гепатоцеллюлярное заболевание, приводящее к портальной гипертензии и портосистемному шунтированию
|
Таблица 2
Ветеринарная модификация Вест-Хейвенской шкалы оценки печеночной энцефалопатии
|
Степень печеночной энцефалопатии |
Клинические симптомы |
|
0 |
Без симптомов |
|
I |
Слабое снижение подвижности, апатия или и то, и другое вместе |
|
II |
Выраженная апатия, легкая атаксия |
|
III |
Сочетание повышенного слюноотделения, тяжелой атаксии, упирания головой в стену, слепоты, кружения по комнате |
|
IV |
Ступор/кома, судорожные припадки |
Тип гепатоэнцуфалопатии
Острая гепатоэнцефалопатия
Она проявляется при острой печеночной недостаточности и является частью совокупности клинических признаков, которые включают быстрое и прогрессирующее ухудшение состояния. У животных часто наблюдаются множественные метаболические/биохимические нарушения, такие как нарушения электролитного баланса или кислотно-щелочного баланса, которые способствуют клиническому проявлению и гипераммониемии. Печеночная энцефалопатия протекает в тяжелой форме, животные часто впадают в ступор или кому (III/IV степень печеночной энцефалопатии). Эти пациенты нуждаются в интенсивном лечении (о котором речь пойдет позже), и прогноз у них неблагоприятный.
Хроническая гепатоэнцефалопатия
Это наиболее распространенная форма заболевания в ветеринарии, вызываемая врожденным или приобретенным портосистемным шунтированием. Хотя были описаны случаи печеночной энцефалопатии при хронических заболеваниях печени, когда шунтирующий сосуд не был идентифицирован, это, скорее всего, вызвано недостаточной чувствительностью тестов для определения этих сосудов, поскольку печень обладает таким большим резервным потенциалом, что изолированная хроническая печеночная недостаточность как причина печеночной энцефалопатии маловероятна.
Факторы, принимающие участие в патогенезе печеночной энцефалопатии
Многие метаболические нарушения, которые могут возникать вследствие заболеваний печени, могут оказывают влияние на центральную нервную систему. Прошло более 100 лет с тех пор, как Nencki и его коллеги описали и исследовали его патогенез у собак с использованием хирургически созданных портосистемных шунтов. Их новаторская работа продемонстрировала, что печень преобразует аммиак в мочевину, а поступление аммиака в системный кровоток и, в конечном счете, в центральную нервную систему приводит к неврологическим нарушениям.
Бесспорно, что аммиак играет центральную роль в патогенезе печеночной энцефалопатии; однако в медицине человека и ветеринарии уже давно признано, что, хотя в популяции людей с хронической печеночной энцефалопатией существует корреляция между содержанием аммиака и уровнем печеночной энцефалопатии, концентрация аммиака является плохим прогностическим фактором печеночной энцефалопатии у человека. В медицине человека печеночная энцефалопатия является скорее диагнозом исключения, чем результатом измерения содержания аммиака. Это привело к проведению клинических и экспериментальных исследований, направленных на понимание того, какие другие факторы важны в патогенезе печеночной энцефалопатии, и концепции синергизма с аммиаком. Было выдвинуто предположение, что многие факторы могут усиливать печеночную энцефалопатию наряду с аммиаком, и в настоящее время наиболее убедительные доказательства имеются для наличие воспаления и марганца (изобр 1).
Аммиак
В настоящее время считается, что большая часть аммиака, образующегося в желудочно-кишечном тракте, образуется в результате преобразования энтероцитами глутамина в глутамат для получения энергии, с меньшей ролью уреаза – продуцирующих бактерий и деградации белка бактерий. Портальная кровь содержит аммиак в концентрациях, которые могут быть нейротоксичными при попадании непосредственно в системный кровоток.
- Детоксикация аммиака в печени
У здоровых животных печень является основным органом детоксикации аммиака. Это достигается двумя основными механизмами. Перипортальные гепатоциты преобразуют аммиак в мочевину через цикл образования мочевины. Мочевина значительно менее токсична и выводится почками. Некоторое количество мочевины подвергается кишечно-печеночной рециркуляции через слюну, желчь или непосредственно диффузией в желудочно-кишечный тракт, где она разлагается бактериями, продуцирующими уреазу. По мере того, как кровь поступает в центрально-дольковую вену, происходит переключение процессов детоксикации аммиака на превращение глутамата в глутамин с помощью фермента глутаминсинтетазы, при этом потребляется аммиак.
Этот переход происходит постепенно через печеночную дольку, таким образом, что перивенозные гепатоциты в основном используют глутамат/глутаминовый путь. Детоксикация аммиака в печени чрезвычайно эффективна, поэтому кровь, поступающая в системный кровоток, содержит низкие концентрации аммиака. Существует большой резервный потенциал, и даже при тяжелой печеночной недостаточности детоксикация аммиака часто сохраняется. При портосистемном шунтировании, в зависимости от фракции шунтирования, различные доли крови с высокой концентрацией аммиака в портальных сосудах попадают непосредственно в системный кровоток.
- Метаболизм аммиака в почках
Почки играют решающую роль в защите организма от гипераммониемии посредством выведения мочевины и аммиака. Большая часть аммиака, который выводится с мочой, образуется в почках. В почках содержится глутаминаза, которая расщепляет глутамин, производя NH+ и HCO3- . Этот механизм важен для поддержания кислотно-щелочного гомеостаза; образующийся аммиак может либо попадать в системный кровоток, либо выводиться с мочой. Метаболический ацидоз увеличивает выведение аммиака с мочой, в то время как алкалоз и гипокалиемия увеличивают выработку аммиака почками, что потенцирует развитие печеночной энцефалопатии. Имеются данные о том, что выработка аммиака почками и выведение его с мочой могут увеличиваться при гипераммониемии.
- Метаболизм аммиака в скелетных мышцах
Скелетные миоциты содержат глютаминсинтетазу и, благодаря своей большой массе, обладают значительной способностью выводить аммиак путем превращения в глютамин. Однако это связывание аммиака носит временный характер, поскольку глутамин высвобождается в системный кровоток, где глутаминазы регенерируют аммиак и глутамат. Тем не менее, этот процесс может выступать в качестве важного буфера для устранения проблем с аммиаком.
- Метаболизм аммиака в центральной нервной системе и патогенез печеночной энцефалопатии
Астроциты - самые многочисленные клетки головного мозга, их доля составляет от 25% до 50% общего обьема мозга. Ключом к патогенезу печеночной энцефалопатии является дисфункция астроцитов. Эти клетки содержат фермент глутаминсинтетазу и действуют как буфер для повышения концентрации аммиака в центральной нервной системе. В результате концентрация глутамата снижается, а концентрация глутамина увеличивается. Глутамат является возбуждающим нейромедиатором, в то время как глутамин является тормозящим. Эти нейромедиаторы циркулируют между астроцитами и нейронами (изобр. 2). Глютамин высвобождается из астроцитов, поглощается нейронами и преобразуется в глутамат ферментом глутаминазой. Глутамат высвобождается в качестве нейромедиатора в синаптической щели. Астроциты быстро поглощают высвобожденный глутамат обратно. Высокие концентрации аммиака повышают уровень внеклеточного глутамина, препятствуя дальнейшему высвобождению из астроцитов, что приводит к повышению внутриклеточной концентрации.
Аммиак также ингибирует ключевые ферменты цикла трикарбоновых кислот, снижая способность астроцитов к аэробному дыханию, вызывая переключение на анаэробное дыхание и выработку лактата. Астроцитарные митохондрии катаболизируют глютамин, высвобождая аммиак, вызывающий окислительный стресс и митохондриальную дисфункцию. Эти метаболические эффекты приводят к набуханию астроцитов. Поскольку астроциты составляют значительную часть объема мозга, при острой печеночной энцефалопатии это приводит к отеку мозга и повышению внутричерепного давления. Этому также способствуют нарушения контроля мозгового кровотока. Это может быстро привести к образованию грыжи, сдавлению ствола мозга и смерти.
При хронической печеночной энцефалопатии набухание астроцитов менее выражено, но все еще присутствует, приводя к образованию астроцитов типа Alzheimer II. Именно такие случаи чаще всего встречаются в ветеринарной медицине, когда корреляция с концентрациями аммиака менее выражена, а другие факторы становятся более значимыми.
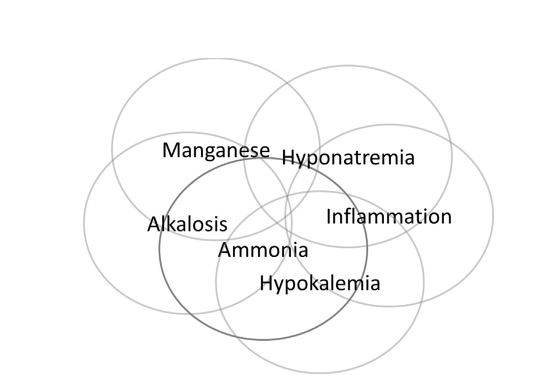
Изобр. 1. Представление факторов, участвующих в патогенезе гепатоэнцефалопатии.
Воспаление
В настоящее время в медицине человека имеются убедительные доказательства того, что воспаление является важным потенцирующим фактором печеночной энцефалопатии. В подтверждение этого было показано, что крысы с экспериментально индуцированной печеночной энцефалопатией восстановили способность к обучению после введения нестероидных противовоспалительных препаратов. Было показано, что у собак с портосистемным шунтом уровень С-реактивного белка повышен у собак с признаками печеночной энцефалопатии и что аммиак и синдром системного воспалительного ответа позволяют прогнозировать наличие печеночной энцефалопатии Любой процесс, вызывающий системную воспалительную реакцию, потенциально может вызывать печеночную энцефалопатию. У собак с портосистемным шунтом наблюдается более высокая концентрация эндотоксинов в портальном и периферическом кровотоке, что позволяет предположить, что желудочно-кишечный тракт и микробиом могут быть важными движущими силами, и, в подтверждение этого, блокирование шунта приводит к снижению циркулирующих маркеров воспаления.
Провоспалительные цитокины усиливают мозговой кровоток и нарушают гематоэнцефалический барьер, повышая проницаемость для аммиака. Гематоэнцефалический барьер препятствует прямому проникновению системных цитокинов в центральной нервной системе. Однако цитокины все еще могут влиять на центральную нервную систему, возможно, через афферентные нервы; активный транспорт через гематоэнцефалический барьер; или через области, в которых гематоэнцефалический барьер отсутствует, такие как циркумвентрикулярные органы. Как медиаторы воспаления, так и аммиак вызывают активацию микроглии и нейровоспаление. У людей было продемонстрировано, что воспаление потенцирует аммиак, провоцируя печеночную энцефалопатию, и что системное воспаление, а не аммиак, связано с тяжелой энцефалопатией.
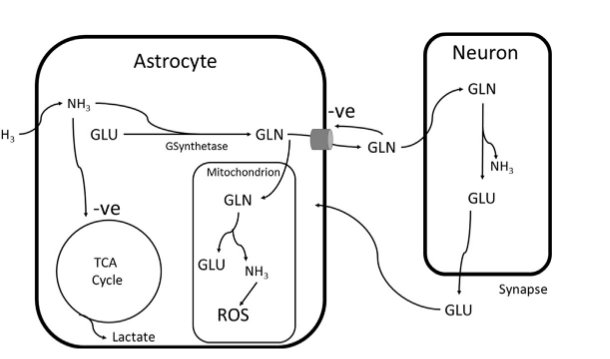
Изобр. 2. Представление о метаболизме аммиака в астроцитах и нейронах. В условиях гипераммонемии уровень глютамина повышается внутриклеточно, что приводит к окислительному повреждению митохондрий, а аммиак ингибирует цикл ТСА. Это нарушает клеточный метаболизм, что приводит к набуханию клеток. GLN, глутамин; GLU, глутамат; GS-синтетаза, глутаминсинтетаза; ROS, активные формы кислорода.
Аммиак и врожденная иммунная дисфункция.
Исследования in vitro и in vivo показали, что фагоцитарная способность нейтрофилов снижается, а активность спонтанного окислительного взрыва возрастает при воздействии аммиака. Снижение фагоцитарной способности на фоне гипераммониемии также наблюдается у нейтрофилов собак in vitro. Это имеет важное значение, поскольку при высоких концентрациях аммиака повышается вероятность инфицирования и повышается активность спонтанного окислительного взрыва, усиливающего синдром воспалительной реакции.
Марганец
Марганец - необходимый микроэлемент, обладающий потенциальной нейротоксичностью, вызывает психические расстройства и когнитивные нарушения. Большая часть (98%) марганца, поступающего в организм и абсорбирующегося, эффективно удаляется печенью и выводится с желчью. Портосистемное шунтирование позволяет крови с высокой концентрацией марганца в висцеральном кровообращении поступать в системный кровоток. Астроциты обладают высокоаффинным механизмом переноса марганца, и его концентрация может быть в 50 раз выше, чем в окружающих клетках. Это приводит к окислительному повреждению и дисфункции митохондрий; было показано, что марганец вызывает астроцитоз Альцгеймера II типа, идентичный тому, что наблюдается при гипераммониемии.
Кроме того, марганец стимулирует микроглию к высвобождению воспалительных цитокинов и активных форм кислорода. Была продемонстрирована прямая взаимосвязь между содержанием марганца в крови, гиперинтенсивностью на сканах МРТ, соответствующей отложению марганца, и тяжестью печеночной энцефалопатии у людей. У собак с портосистемным шунтом и хроническими заболеваниями печени содержание марганца в крови выше, чем у контрольных животных. При проведении МРТ собак и кошек с портосистемным шунтом были обнаружены поражения центральной нервной системы, связанные с отложением марганца и есть одно сообщение о собаке с портосистемным шунтом, у которой при посмертном исследовании была повышена концентрация марганца в центральной нервной системе.
Кислотно-щелочные и электролитные нарушения
Гипонатриемия, гипокалиемия и алкалоз - все они, как известно, усиливают печеночную энцефалопатию у людей. Гипонатриемия усиливает отек мозга, в то время как гипокалиемия усиливает аммиакогенез в почках и снижает почечную экскрецию аммиака. Хотя вполне вероятно, что они также могут усиливать печеночную энцефалопатию у наших пациентов, доказательств этого недостаточно, и исследования, проведенные на сегодняшний день, не выявили никакой связи. Это может отражать низкую распространенность этих нарушений у наших пациентов, отчасти из-за различий в основной этиологии печеночной энцефалопатии (портосистемный шунт в сравнении с хроническим гепатитом) и тяжести патологического процесса; в случаях с хроническим гепатитом наши пациенты могут быть подвергнуты эвтаназии до того, как возникнут эти осложнения.
Неврологические последствия дисфункции астроцитов
При острой печеночной энцефалопатии основным патологическим последствием является отек мозга и повышение внутричерепного давления, вызванные увеличением астроцитов. При хронической печеночной энцефалопатии главным следствием всех этих факторов является нарушение регуляции нейромедиаторов. В дополнение к дисбалансу глутамата и глутаминового белка, при печеночной энцефалопатии уже давно был выявлен повышенный “ГАМКергический тонус”. G-аминомасляная кислота (ГАМК) является основным тормозящим нейромедиатором, снижающим возбудимость. Первоначально предполагалось, что это повышение тонуса вызвано повышенным cинтезом ГАМК; однако исследования на собаках с экспериментально индуцированным билиарным циррозом печени и собаках с экспериментально созданными портокавальными шунтами не выявили увеличения ГАМК или ГАМК-рецепторов центральной нервной системы. Это привело к поиску альтернативных лигандов.
В настоящее время известно, что ГАМК-рецепторы активируются группой соединений, известных как “ нейростероиды”, к которым относятся аллопрегнанолон и тетрагидродезоксикортикостерон. Было показано, что уровень этих соединений значительно повышается у людей с печеночной энцефалопатией. Нейростероиды синтезируются в ответ на активацию белка-транслокатора в митохондриях астроцитов (ранее известных как бензодиазепиновые рецепторы периферического типа). Количество этих рецепторов увеличивается у людей с циррозом печени. Исследования in vitro показали, что белок-транслокатор астроцитов в значительной степени регулируется аммиаком, а также марганцем.
Диагностика гепатоэнцефалопатии
Концентрация аммиака в артериях и венах является ненадежным показателем печеночной энцефалопатии. Следует поддерживать высокий индекс подозрительности у животных с заболеваниями печени или у тех, у кого может быть портосистемный шунт. Высокая концентрация аммиака делает вероятной печеночную энцефалопатию; однако нормальные значения не исключают этого диагноза. Во избежание повышения концентрации аммиака в пробирке важно тщательно обрабатывать пробы для определения содержания аммиака. Рутинная клиническая патология позволяет исключить другие метаболические причины неврологических заболеваний и позволяет выявить заболевания печени/ее недостаточность. Результаты визуализации брюшной полости могут подтвердить наличие приобретенных заболеваний печени и, в некоторых случаях, наличие системного шунтирования.
Лечение печеночной энцефалопатии
Устранение основной причины
У животных с врожденными портосистемными шунтами сужение шунта часто приводит к быстрому увеличению массы и функции печени. Перед шунтированием рекомендуется провести медицинское обследование. Кроме того, некоторые случаи с врожденными портосистемными шунтами могут не подходить для лечения из-за финансовых возможностей клиента, сопутствующих заболеваний пациента или анатомии шунта. По возможности, необходимо следует устранить причину, вызывающую острую печеночную недостаточность; например, пациентам с токсичностью, вызванной ацетаминофеном, следует провести дезактивацию желудочно-кишечного тракта и восполнить дозу глутатиона, что может помочь уменьшить продолжающуюся гепатотоксичность.
Оценка и устранение провоцирующих факторов
На развитие гепатоэнцефалопатии влияют многие факторы. Пациентов следует обследовать на наличие очага воспаления/сепсиса, а также оценить их электролитный и кислотно-щелочной статус. Существует множество факторов, влияющих на повышение концентрации аммиака в крови, включая обезвоживание, прием пищи с высоким содержанием белка, желудочно-кишечные кровотечения (вызывающие переваривание гемоглобина и также являющиеся очагом воспаления), уремия и запоры. Если таковые выявлены, их следует устранить.
Острая печеночная энцефалопатия, вызванная печеночной недостаточностью
Эти случаи обычно сопровождаются несколькими тяжелыми сопутствующими заболеваниями, в первую очередь коагулопатией и органной дисфункцией, которые требуют интенсивного лечения. В этих случаях часто наблюдаются ступор/коматозное состояние, требующее интубации для защиты дыхательных путей, а в некоторых случаях и искусственной вентиляции легких.
Часто встречается гипогликемия, и во время госпитализации пациентов следует регулярно контролировать кровь на предмет этого осложнения. Большое беспокойство вызывает отек мозга в результате гипераммониемии, приводящий к повышению внутричерепного давления. Чтобы свести к минимуму этот риск, голова пациента должна быть приподнята на 30 градусов и не должен нарушаться дренаж яремной вены (т.е. не следует брать кровь из яремной вены, нужно снять ошейники). Для поддержания нормоволемического состояния следует использовать внутривенные вливания. При церебральной гипертензии при подозрении на гипертонию рекомендуется внутривенное введение маннита в дозе от 0,5 до 1 г/кг в течение 20 минут. Затем процедуру можно повторить после через 4 часа, но из-за осмотического диуретического эффекта необходимо контролировать уровень электролитов в сыворотке/плазме крови.
Рекомендуется искусственная вентиляция легких для поддержания уровня парциального уровня CO2 на уровне 30-40 мм рт .ст. Чрезмерно интенсивное снижение парциального уровня СО2 приводит к снижению церебральной перфузии и оксигенации, и поэтому его необходимо предотвращать. Следует принять меры по снижению уровня аммиака (о которых речь пойдет позже). В медицине наряду с этими вмешательствами применяют терапевтическую гипотермию, временную гепатэктомию (удаление очага некроза и воспаления) и, в конечном счете, трансплантацию печени. В ветеринарной медицине эти передовые методы лечения недоступны, и в результате ограниченных возможностей лечения прогноз для собак с молниеносной печеночной недостаточностью является плохим.
Хроническая печеночная энцефалопатия
Любое животное с обострением клинических симптомов должно быть тщательно обследовано на предмет провоцирующих факторов (изобр. 3). Животным с признаками сепсиса требуется внутривенное эмпирическое введение антибиотиков в ожидании результатов посева и определения чувствительности. Следует активно бороться с инфекцией или воспалительными очагами. Следует пересмотреть назначение сопутствующих препаратов на предмет возможного обезвоживания, электролитных нарушений или гепатотоксичности. При кровотечениях из верхних отделов желудочно-кишечного тракта часто применяют омепразол и сукральфат, наряду с другими поддерживающими мерами. Уровень вмешательства зависит от тяжести клинических признаков; животным III/IV степени тяжести может потребоваться интубация для защиты от аспирации (изобр. 4).
Внутривенное введение жидкости
Многие животные с печеночной энцефалопатией испытывают обезвоживание и/или гиповолемию из- за нарушения уровня сознания, снижающего потребление воды, и провоцирующих причин (например, диареи/желудочно-кишечного кровотечения). Восстановление нормоволемии снижает концентрацию аммиака за счет разбавления и улучшает выведение аммиака и мочевины с мочой, а также предотвращает образование аммония бактериями, продуцирующими уреазу в толстой кишке. Диурез дополнительно улучшает ренальную экскрецию. Некоторые врачи не рекомендуют животным с печеночной недостаточностью употреблять жидкости, содержащие лактат, поскольку эта добавка требует метаболизма в печени.
Клизмы
Клизмы физически удаляют содержимое толстой кишки и, следовательно, источник азота для бактерий, продуцирующих уреазу. Физическое удаление гемоглобина при желудочно-кишечных кровотечениях предотвращает бактериальную деградацию гемоглобина и образование аммония. Очистительные клизмы с теплой водой или изотоническими жидкостями используются до тех пор, пока не будет выводиться прозрачная жидкость. Затем используются удерживающие клизмы; в качестве альтернативы можно использовать теплую воду, неомицин, йод или нерассасывающиеся дисахариды (лактулозу и лактитол). Нет исследований, в которых оценивалась бы эффективность удерживающих клизм у ветеринарных пациентов. Одно медицинское исследование показало, что клизмы, содержащие лактулозу и лактитол, более эффективны, чем теплая вода. Автор использует одну часть лактулозы на три части теплой воды, вводимой через катетер Фолея в дозе 10 мл/кг, удерживаемой от 30 минут до 1 часа.

Изобр. 3. Предлагаемый подход к пациенту с признаками печеночной энцефалопатии.
Лактулоза/лактитол
Это неусваиваемые дисахариды, которые расщепляются бактериями толстой кишки с образованием летучих жирных кислот, включая уксусную, молочную и масляную кислоты. Подкисление толстой кишки способствует образованию ионов аммония NH4+, которые в меньшей степени способны проникать через клеточные мембраны, образуя в толстой кишке аммиачную “ловушку”. Раствор лактулозы сам по себе кислый, и это может быть причиной того, что клизмы с лактулозой (обсуждавшиеся ранее) эффективны для улучшения клинических проявлений. Эти летучие жирные кислоты также действуют как осмотические слабительные, выводя из организма аммиак и азот. В долгосрочной перспективе эти продукты действуют как пробиотики, благоприятствуя бактериям, не являющимся пищевыми продуктами, и снижая выработку аммиака из толстого кишечника. Дозу подбирают таким образом, чтобы вызвать два-три мягких стула в день, начиная с дозы 0,5 мл/кг перорально два раза в день. Лактитол представляет собой порошок и, при наличии, может использоваться животными, которые не принимают лактулозу. Передозировка этих препаратов вызывает осмотическую диарею, которая может привести к гипернатриемии и снижению выведения аммиака и мочевины почками.
Диета
Хотя рацион с низким содержанием белка и, таким образом, снижение потенциального производства аммиака может показаться логичным, такой подход может иметь и негативные последствия. Недостаточное количество белка в рационе вызывает катаболизм тканей с уменьшением мышечной массы, что приводит к выделению аммиака, снижая способность животного к буферизации с помощью глютаминсинтетазы в скелетных мышцах. Кроме того, при приобретенном шунтировании, вызванном портальной гипертензией, любое снижение уровня сывороточного альбумина снижает онкотическое давление, усиливая асцит. Поскольку считается, что большая часть аммония образуется в результате метаболизма энтероцитов, превращающего глутамин в глутамат, неясно, насколько важен пищевой белок для выработки аммиака.
Людям с гепатоэнцефалопатией больше не рекомендуется ограничивать потребление белка, а у собак с врожденными портосистемными шунтами потребность в белке в рационе такая же, как у контрольных животных. Рекомендуется использовать легкоусвояемый источник белка с высокой биологической ценностью, но в идеале содержание белка в рационе должно соответствовать возрасту и фазе роста животного. Исключения из этого правила составляют случаи на начальном этапе периода стабилизации для контроля клинических признаков или если, несмотря на другие методы лечения, клинические признаки сохраняются при стандартном белковом рационе. Приблизительный уровень белковой нормы, равный 4 г белка на 100 ккал в день, может быть отправной точкой для увеличения количества белка в рационе собаки. Коммерческие ветеринарные диеты для собак с заболеваниями печени варьируют, но, как правило, находятся примерно на этом уровне.
Коммерческие диеты для собак с заболеваниями печени имеют много преимуществ: они содержат мало меди для предотвращения вторичного накопления меди при хроническом гепатите, дополнены цинком, антиоксидантом, необходимым для оптимального функционирования цикла образования мочевины и содержат белок высокой усвояемости и биологической ценности. Однако в коммерческих рационах для собак с заболеваниями печени, особенно для молодых животных, при длительном применении часто содержится слишком мало белка. Необходимо добавлять другой высококачественный источник белка, такой как творог или тофу. Есть данные, что растительные источники белка могут улучшить контроль по сравнению с рационами, основанными на мясе. Поскольку в процессе пищеварения в желудочно-кишечном тракте происходит аммониогенез, рекомендуется давать пищу небольшими порциями и часто. Рекомендуется следить за весом, состоянием мышц и уровнем сывороточного альбумина, чтобы убедиться в том, что потребности животных в калориях и белке удовлетворяются при длительном медикаментозном лечении. При возникновении сомнений врачам рекомендуется проконсультироваться с сертифицированным ветеринарным диетологом.

Изобр. 4. Самоед с врожденным портосистемным шунтированием и гепатоэнцефалопатией III степени, вызванной желудочно-кишечным кровотечением. Этого пациента можно было разбудить с помощью раздражителей.
Антибиотики
Антибиотики используются для уменьшения количества бактерий, продуцирующих уреазу в желудочно-кишечном тракте. Исходя из этого, разумным выбором были бы неабсорбируемые антибиотики. Ранее был рекомендован неомицин; однако может наблюдаться некоторая системная абсорбция, приводящая к почечной и ототоксичности. В медицине широко используется рифаксимин-а, полусинтетический неабсорбируемый антибиотик, который эффективен при лечении и профилактике печеночной энцефалопатии. Имеются фармакокинетические данные по собакам, подтверждающие, по крайней мере, у здоровых животных, отсутствие системного всасывания. В настоящее время основным препятствием для использования этого препарата в ветеринарии является его стоимость.
Из-за ранее упомянутых проблем часто используются системные антибиотики, включая метронидазол, ампициллин и потенцированный амоксициллин. Метронидазол нарушает метаболизм в печени, поэтому рекомендуется снижать дозу до 7,5 мг/кг каждые 8-12 часов. Учитывая растущую обеспокоенность в связи с устойчивостью животных к антибиотикам, реко мендуется применять антибиотики в краткосрочной перспективе или в тех случаях, когда у животных наблюдается обострение. Несмотря на это, есть случаи, когда на фоне лечения антибиотиками наблюдается клиническое улучшение.
Будущие варианты лечения
Усиление метаболизма аммиака
L-аспартат L-орнитина представляет собой смесь двух аминокислот, которые являются субстратами для цикла образования мочевины, а также стимулируют выработку глютамина в печени и скелетных мышцах. Он вводится путем внутривенной инфузии и эффективен у людей с выраженной печеночной энцефалопатией; однако эффект кратковременен, поскольку после прекращения инфузии концентрация аммиака восстанавливается. Существует серия случаев, когда сообщалось о его применении у собак, хотя нельзя утверждать о его эффективности. Подобно L-орнитин-L-аспартату, фенилацетат орнитина повышает активность глутаминсинтетазы; однако глютамин в этом случае связывается с фенилацетатом и выводится почками, предотвращая выделение аммиака. В настоящее время это соединение проходит клинические испытания на людях. Альтернативным соединением с идентичным конечным продуктом является фенилбутират глицерина, который также оказался эффективным в клинических испытаниях. Нет информации об их применении у домашних животных.
Модуляция микробиома фекалий
Потенциальными преимуществами этого являются уменьшение количества бактерий, продуцирующих уреазу, и уменьшение количества провоспалительного микробиома, что снижает количество эндотоксинов и воспалительных цитокинов. Текущее применение лактулозы и растительного белка может действовать этим же способом. У людей с циррозом печени был выявлен дисбактериоз кишечника при печеночной энцефалопатии. Существует интерес к другим пребиотикам и пробиотикам, а также к трансплантации фекальной микробиоты для борьбы с печеночной энцефалопатией в медицине человека. В настоящее время неизвестно, возникает ли дисбактериоз у домашних животных при печеночной энцефалопатии.
Снижение уровня провоспалительных цитокинов/воспаления
Поскольку одним из источников воспаления является микробиом кишечника, модуляция этого процесса может улучшите контроль. Считается, что разработанный углеродный адсорбент (AST-120), принимаемый перорально, адсорбирует аммиак, эндотоксин и фактор некроза опухоли-a, хотя первоначальное исследование не продемонстрировало улучшения у людей со скрытой формой печеночной энцефалопатии. Другими препаратами являются миноциклин, который снижает активацию микроглии, а также etanercept и infliximab, которые снижают активность микроглии, нейтрализуют фактор некроза опухоли-а, все они находятся в стадии изучения для борьбы с печеночной энцефалопатии в медицине человека.
Выводы
В настоящее время все долгосрочные стратегии ведения животных с гепатоэнцефалопатией у животных-компаньонов направлены на снижение концентрации аммиака. В результате интенсивных исследований стало ясно, что аммиак является не единственным фактором, и что ранее существовавшие представления об источнике аммиака, а также о механизмах действия текущих методов лечения изменились. Поскольку число заболеваний печени и, как следствие, печеночной энцефалопатии среди людей растет, исследования в области терапии продолжаются быстрыми темпами. Из проведенных на сегодняшний день ветеринарных исследований следует, что патогенез печеночной энцефалопатии у собак аналогичен таковому у людей, и есть надежда, что при необходимой проверке достижения в области медицины человека будут использованы в ветеринарии.
Новая переводная статья в Телеграм
(краткое содержание)
https://t.me/veterinar66
Функциональная диспепсия: от человека к собаке, ретроспективное исследование 29 случаев, иллюстрирующих сложную патологию.
BMC Veterinary Research
October 2025
200 видео патологических непроизвольных движений у собак и кошек с описанием.
Видео можно смотреть по платной подписке в Телеграме.
Список видео:
Часть 2: пароксизмальная дискинезия и дистония
Полезные статьи
- 70 переводных статей об эпилепсии собак и кошек
- Судорожные припадки и эпилепсия у кошек
- Судорожные припадки у собак
- Парез\паралич и слабость лап у собак и кошек
- Нарушения равновесия у собак и кошек
- Боль у собак и кошек с неврологическим заболеванием
- Симптомы при разной локализации неврологических нарушений у собак и кошек






