.jpg)
- Прием в клинике, выезд на дом и дистанционные консультации по E-mail и WhatsAp
- УЗИ сердца собакам и кошкам в клинике и с выездом на дом на аппарате высокого класса
Journal of Veterinary Internal Medicine November 2023
https://onlinelibrary.wiley.com/doi/10.1111/jvim.16928
Marios Charalambous, Karen Muñana, Edward E. Patterson, Simon R. Platt, Holger A. Volk
Перевод с англ.: ветеринар - невролог Васильев
Сокращенная статья
Оглавление
1 Введение
2 Определение и классификация
2.1 Продолжительность и частота встречаемости
2.2 Типы и семиология
3.5 Разработка рекомендаций
4 Результаты и рекомендации
6 Лечение первой линии
6.1 Какие препараты первой линии используются для лечения эпилептического статуса вне стационара и в стационарных условиях?
6.2 Обоснование
6.3 Мидазолам или диазепам?
6.4 Обоснование
6.5 По истечении какого периода времени болюсное введение бензодиазепина следует считать эффективным? Когда следует начинать внутривенное введение бензодиазепина с постоянной скоростью введения ?
6.6 Обоснование
7 Лечение второй линии
7.1 Обоснование
8 Лечение третьей линии
8.1 Обоснование
9 Что делать, если комплексные меры, включающие лечение первой, второй и третьей линии, а также поддерживающую терапию, по – прежнему не приводят к прекращению судорожной активности?
9.1 Обоснование
10 Когда следует прекратить прием дополнительных противоотечных препаратов ?
10.1 Обоснование
11 Если эпилептический статус прекращен, как мне следует уменьшать обьем лечения?
11.1 Обоснование
12 Руководства и рекомендации по лечению групповых судорожных припадков
12.1 Обоснование
13 Выводы
Введение
Судорожные расстройства, включая эпилептический статус и групповые судорожные приступы, являются распространенными неврологическими проблемами, требующими неотложной медицинской помощи у ветеринарных врачей первичного звена, врачей неотложной помощи и специалистов специализированной практики и связаны с высокой заболеваемостью и смертностью. Эпилептический статус, в частности, остается терапевтической проблемой у животных с уровнем смертности от 25,3% до 38,5%, и может привести к необратимому повреждению головного мозга и системным осложнениям, особенно если лечение откладывается. Осложнения и молекулярные изменения могут возникать на ранних стадиях заболевания. Судороги могут быстро стать самоподдерживающимися и невосприимчивыми к стандартным противосудорожным препаратам.
В ветеринарной медицине было предложено несколько схем лечения и алгоритмов для экстренного лечения судорожных припадков. Однако эти рекомендации основаны в основном на мнениях отдельных экспертов, не имеют официального подтверждения и характеризуются значительными различиями. Несмотря на то, что были опубликованы официальные рекомендации и согласованные заявления по лечению эпилепсии, отсутствуют аналогичные руководства по ведению неотложных судорожных расстройств. Таким образом, целью данных Согласованных рекомендаций является унификация существующей практики и установление основанных на фактических данных руководящих принципов и согласия между сертифицированными специалистами, которые могут служить рекомендациями по надлежащему лечению эпилептического статуса и групповых судорожных приступов у собак и кошек.
2 Определение и классификация
2.1 Продолжительность и частота встречаемости
Судорожные припадки считаются чрезвычайной ситуацией, когда их продолжительность увеличивается и они не являются самоограничивающимися, или когда они происходят в виде серий с короткими интервалами. Традиционно припадки можно определить как “кратковременные” или “продолжительные”, если их продолжительность составляет менее 5 или от 5 до 30 минут соответственно. По данным Международной лиги по борьбе с эпилепсией (ILAE) и Американского общества по борьбе с эпилепсией (AES), эпилептический статус относится к непрерывной судорожной активности, или > одного последовательного припадка без полного восстановления сознания в промежутке между ними, продолжительностью >30 минут. Временные рамки в 30 минут были основаны на продолжительности конвульсивного эпилептического статуса, которая необходима для того, чтобы вызвать необратимые осложнения и повреждение нейронов. Однако, поскольку большинство припадков кратковременны, а если припадок длится более 5 минут, то, скорее всего, он будет продолжительным и, возможно, не будет самоограничивающимся, исследователи и клиницисты повсеместно приняли 5-минутные временные рамки в качестве определяющего элемента эпилептического статуса.
Ограничение длительности припадка 5 минутами позволяет (i) минимизировать риск системных и мозговых осложнений, связанных с непрерывной судорожной активностью, достигающей 30 минут, (ii) предотвратить ухудшение прогноза и лекарственной устойчивости, связанных с увеличением продолжительности неконтролируемой судорожной активности, и (iii) ограничить любые потенциально неблагоприятные исходы и побочные эффекты, связанных с длительным применением нескольких терапевтических (включая анестезию) вмешательств при кратковременных и самоограничивающихся приступах.
Соответственно, ILAE пересмотрела определение эпилептического статуса, включив в него оба этих жизненно важных момента времени, и определяет эпилептический статус как любой длительный судорожный припадок, длящийся более 5 минут. В частности, “ эпилептический статус - это состояние, возникающее либо в результате сбоя механизмов, ответственных за прекращение судорожных припадков, либо в результате запуска механизмов, которые приводят к аномально длительным судорожным припадкам (по истечении времени T1 = 5 минут).; это состояние, которое может иметь долгосрочные последствия (по истечении времени T2 = 30 минут), включая гибель нейронов и изменение нейронных сетей.”
Аналогичный временной интервал в 5 минут был использован для определения эпилептического статуса Международной ветеринарной целевой группой по эпилепсии (IVETF); целевая группа также включила в свое определение эпилептического статуса ≥ 2 судорожных припадков без восстановления сознания между ними. Это определение эпилептического статуса содержит рекомендации относительно того, когда следует начинать неотложную помощь. В целом, T1 - это момент времени, к которому лечение уже должно было быть начато; T2 представляет собой время, в течение которого прогрессирует повреждение нейронов или самоподдерживающееся изменение нейронных сетей, и, следовательно, это самое позднее время, к которому эпилептический статус должен быть под контролем.
Эпилептический статус можно разделить на 4 стадии, которые различаются по вариантам лечения, чувствительности к применяемым лекарствам и основным патофизиологическим процессам.
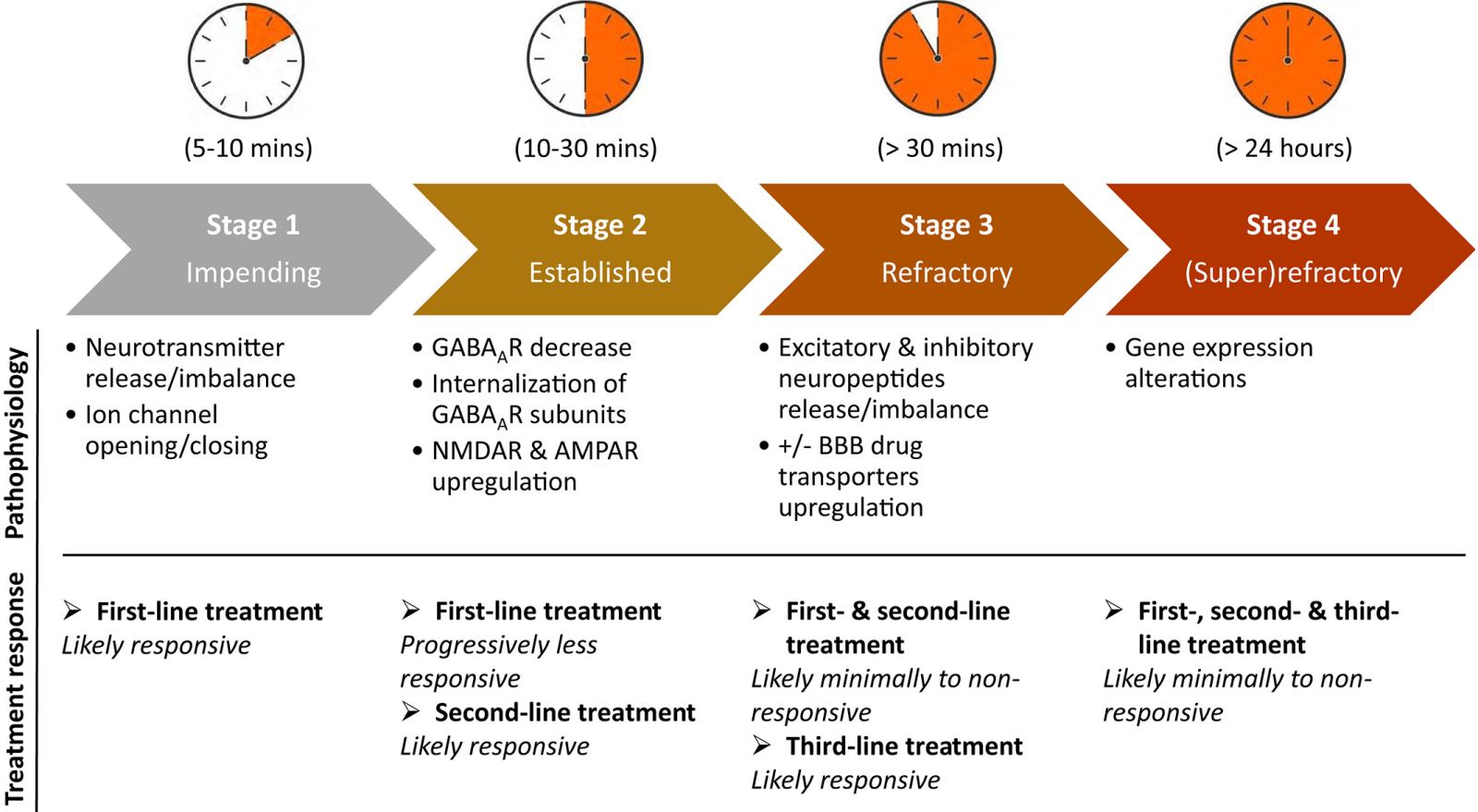
Изобр. 1 Иллюстрация стадий эпилептического статуса и их различий в отношении основных патофизиологических процессов и чувствительности к используемым лекарствам.
Групповые (кластерные) припадки у человеков и животных в широком смысле определяются как >2 самоограничивающихся судорожных припадка в течение 24 часов. Групповые припадки, особенно частые, (i) могут представлять риск повреждения нейронов и осложнений, связанных с судорожными припадками, аналогично эпилептическому статусу, (ii) могут прогрессировать до эпилептического статуса, и (iii) маловероятно, что они прекратятся или будут надлежащим образом контролироваться без экстренного медикаментозного лечения.
2.2 Типы и семиология
Согласно ILAE, клинические формы эпилептического статуса у людей дифференцируются на основе двух таксономических критериев: двигательной активности и нарушения сознания. Следовательно, эпилептический статус может быть охарактеризован как (i) эпилептический статус с выраженными двигательными признаками (т.е. конвульсивный эпилептический статус , миоклонический эпилептический статус, фокальный конвульсивный эпилептический статус, тонический эпилептический статус и гиперкинетический эпилептический статус ) или (ii) эпилептический статус без выраженных двигательных симптомов (т.е. неконвульсивный эпилептический статус). Каждый тип может быть снова разделен в зависимости от степени нарушения сознания. Конвульсивный эпилептический статус характеризуется нарушением сознания с генерализованными или генерализованными с фокальным началом двигательными симптомами.
Неконвульсивный эпилептический статус может быть коматозным или некоматозным. Коматозное состояние обычно наблюдается после конвульсивного эпилептического статуса и характеризуется отсутствием какой-либо двигательной активности, хотя может наблюдаться незначительный миоклонус или нистагм. Некоматозный конвульсивный эпилептический статус обычно протекает в форме генерализованного абсансного статуса (например, пациенты-люди могут быть вялыми с измененным поведением, иметь замедленную речь или аномальные движения, включая региональный двусторонний миоклонус век, периоральной области или области верхних конечностей) или в форме фокального эпилептического статуса с нарушением сознания (например, пациенты-люди могут быть разговорчивыми и интерактивными, но при этом испытывать замешательство и вегетативные, сенсорные, зрительные, обонятельные, вкусовые, слуховые или эмоциональные симптомы). В целом, хотя явные судороги при неконвульсивном эпилептическом статусе отсутствуют, наблюдаются едва заметные двигательные симптомы, такие как подергивания, моргание, могут наблюдаться экстрапирамидные симптомы или миоклонус.
Кроме того, несмотря на отсутствие судорожной активности, неконвульсивный эпилептический статус все еще может приводить к повреждению нейронов и клеточным механизмам апоптоза, что делает раннее распознавание и лечение такими же важными, как и при конвульсивном эпилептическом статусе. Иктальная электроэнцефалография является ценным инструментом в диагностике всех видов эпилептического статуса, но наиболее важна при неконвульсивном эпилептическом статусе , поскольку клинические признаки часто малозаметны и неспецифичны. При конвульсивном эпилептическом статусе сочетание клинического диагноза с выявлением двигательной активности, связанной с судорогами, и того факта, что при конвульсивном эпилептическом статусе электроэнцефалограмма может быть перегружена движениями и мышечными артефактами, делает малозначимой ее клиническую ценность.
Аналогичная классификация может быть применена и к животным. Однако широкая клиническая симптоматология конвульсивного эпилептического статуса и неконвульсивного эпилептического статуса , о которой сообщалось у людей, не наблюдалась и официально не описана у животных. Наиболее распространенной формой конвульсивного эпилептического статуса у животных, о которой сообщается, является генерализованный (тонико -клонический) конвульсивный эпилептический статус. Однако, диагноз конвульсивного эпилептического статуса и, в особенности, неконвульсивного эпилептического статуса у ветеринарных пациентов может быть пропущен, главным образом, из-за недостаточного опыта в проведении иктальной электроэнцефалографии. Имеется лишь несколько сообщений об использовании электроэнцефалографии для диагностики неконвульсивного эпилептического статуса.
При отсутствии конвульсивного эпилептического статуса следует подозревать неконвульсивный эпилептический статус у любого животного с длительным периодом измененного сознания (коматозного или некоматозного типа) после успешного купирования судорожных припадков, особенно после отмены любых общих анестетиков или седативных препаратов. Электроэнцефалография должна быть выполнена каждому ветеринарному неврологическому пациенту с нарушением сознания или его отсутствием, чтобы оценить возможность развития неконвульсивного эпилептического статуса и перед применением какого-либо конкретного плана лечения, но комиссия признает, что в большинстве ветеринарных учреждений это может оказаться невозможным.
3.5 Разработка рекомендаций
Рекомендации ACVIM для каждого отдельного варианта лечения были основаны на сочетании двух элементов: (i) текущих данных опубликованных исследований и (ii) экспертного мнения каждого члена комиссии, учитывающего общие знания в данной области. Что касается элемента (i), то для каждого конкретного вмешательства члены комиссии независимо друг от друга собрали и обобщили результаты оценки качества имеющихся фактических данных и результатов лечения по всем исследованиям. Участники указали количество исследований, которые высказались за или против использования каждого вмешательства, и представили шкалу “уровня доказательности” для каждого вмешательства. В частности, шкала “уровня доказательности” была основана на общих оценках качества доказательств в исследованиях и включала:
I — “Высокий уровень доказательности за или против вмешательства”: когда по крайней мере в 2 клинических исследованиях с общей оценкой высокого качества оценивалось использование вмешательства для лечения эпилептического статуса или групповых судорожных припадков у собак или кошек.
II — “Умеренный уровень доказательности за или против вмешательства”: когда по крайней мере в 2 клинических исследованиях с общим средним баллом качества или в 1 клиническом исследовании с общим высоким баллом качества оценивалось использование вмешательства для лечения эпилептического статуса или групповых судорожных припадков у собак или кошек.
III — “Низкий уровень доказательств за или против вмешательства”: при проведении ≥1 клинического исследования с общей оценкой низкого качества или 1 клинического исследования с общей оценкой среднего качества, или когда существуют только фармакокинетические исследования, без каких-либо существующих исследований с общей оценкой высокого качества, оценивающих применение препарата. для лечения эпилептического статуса или групповых судорожных припадков у собак или кошек.
IV — “Противоречивый уровень доказательности”: когда минимум в 2 клинических исследованиях (особенно с общими оценками высокого качества) оценивалось использование конкретного вмешательства для лечения эпилептического статуса или групповых судорожных припадков у собак или кошек в качестве основного результата лечения; однако были получены противоречивые результаты относительно эффективности или безопасности вмешательства. или были показаны оба варианта.
V— “Отсутствие доказательств”: когда не проводилось ни клинических, ни фармакокинетических исследований, оценивающих применение препарата для лечения эпилептического статуса или групповых судорожных припадков у собак или кошек.
Что касается оценки элемента (ii), то она была основана не только на оценке фактических данных, полученных в рамках элемента (i), но и на собственной критической оценке группы (личный опыт и знания, информация об использовании вмешательства в первичной и специализированной клинической практике, обзоры литературы или учебников). Как было описано ранее, в тех случаях, когда результаты ветеринарных клинических или фармакокинетических исследований были ограничены или вообще отсутствовали в отношении использования конкретного вмешательства при неотложных судорожных расстройствах, для поддержки рекомендаций комиссии были привлечены экспериментальные и фундаментальные исследования или исследования на людях.
Шкала рекомендаций ACVIM, использованная авторами для этих Согласованных рекомендаций, включала::
А— Высокая рекомендация: вмешательство, скорее всего, является эффективным и безопасным методом лечения.
В —Умеренная рекомендация: вмешательство, возможно, является эффективным и безопасным методом лечения.
С—Низкая рекомендация: вмешательство, возможно, является недостаточно эффективным и безопасным методом лечения.
Д— Вмешательство не рекомендуется к применению: неэффективное или небезопасное лечение или и то, и другое вместе.
Е — Возможная рекомендация: вмешательство может быть потенциально эффективным и безопасным методом лечения, но в настоящее время его применимость, осуществимость и эффективность ограничены отсутствием доказательств, клинического опыта или того и другого вместе.
Наконец, в дополнение к разработке рекомендаций относительно использования каждого вида вмешательства при эпилептическом статусе и групповых судорожных припадках у собак и кошек, группа авторов Рекомендаций также представила конкретные клинические концепции лечения судорожных припадков в экстренных случаях, подкрепленные современными научными данными, знаниями и клиническим опытом
4 Результаты и рекомендации
Поиск выявил 1892 уникальных упоминания для эпилептического статуса и 1284 для групповых судорожных припадков; 112 исследований (эпилептический статус) и 53 исследования (групповые судорожные припадки) соответствовали критериям скрининга 1-го этапа. После исключения дубликатов остались 87 (эпилептический статус) и 28 (групповые судорожные припадки) исследований, которые вошли во 2-ю стадию скрининга. Из них 38 клинических исследований (эпилептический статус; собаки, n = 36; кошки, n = 5) и 12 клинических исследований ( групповые судорожные припадки; собаки, n = 12; кошки, n = 0), а также поскольку 37 фармакокинетических исследований (собаки, n = 33; кошки, n = 4) соответствовали критериям 2-го этапа, они были отобраны для обзора. В некоторых клинических исследованиях участвовали смешанные популяции собак и кошек.
У собак общее качество доказательств включало 17% (эпилептический статус, n = 6) и 25% (групповые судорожные припадки, n = 3) исследований высокого качества, 50% (эпилептический статус, n = 18) и 58% (групповые судорожные припадки, n = 7) исследований среднего качества и 33% (эпилептический статус, n = 12) и 17% (групповые судорожные припадки, n = 2) исследований низкого качества. У кошек общее качество доказательств включало 20% (эпилептический статус, n = 1) исследований высокого качества, 60% (эпилептический статус, n = 3) исследований среднего качества и 20% (эпилептический статус, n = 1) исследований низкого качества; исследований по групповым судорожным припадкам, основанных на критериях включения, выявлено не было.
Результаты оценки качества доказательств и результатов лечения в каждом исследовании представлены в дополнительных файлах 2-4. Уровень доказательной базы и рекомендации, касающиеся каждого вмешательства, используемого для лечения эпилептического статуса и групповых судорожных припадков, обобщены в дополнительном файле 5 в дополнение к иерархическим пирамидам.
ACVIM пирамида иерархии рекомендаций противосудорожного лечения при эпилептическом статусе у собак
А Высокая рекомендация Мидазолам (внутривенный болюс или внутривенная инфузия с постоянной скоростью; интраназально) – Диазепам (внутривенный болюс) – Пропофол (внутривенный болюс или внутривенная инфузия с постоянной скоростью) – Кетамин (внутривенный болюс или внутривенная инфузия с постоянной скоростью) – Фенобарбитал (внутривенно)
В Умеренная рекомендация Мидазолам (внутримышечно) – Диазепам (внутривенная инфузия с постоянной скоростью; интраназально) - Лоразепам (внутривенно) – Леветирацетам (внутривенно) – Пентобарбитал (внутривенный болюс или внутривенная инфузия с постоянной скоростью) –(Декс)медетомидин - (внутривенный болюс или внутривенная инфузия с постоянной скоростью) - Фосфенитоин (внутривенно) - Дыхательные анестетики
С Низкая рекомендация Мидазолам (буккально) – Диазепам (ректально) – Леветирацетам – (внутримышечно, орально, ректально) – Топирамат – (внутривенно)
Д Не рекомендуется к применению Мидазолам (ректально; орально) – Диазепам (внутримышечно, орально)-Лоразепам (ректально) – Топирамат (орально)
Е Возможная рекомендация Диазепам (буккально, эндотрахеально)- Лоразепам (интраназально) - Декс)медетомидин (внутримышечно) – Хлорпромазин (орально) – Аллопрегнанолол (внутривенно, внутримышечно) – Магнезия (внутривенно) – Нейростимуляция
ACVIM пирамида иерархии рекомендаций противосудорожного лечения при эпилептическом статусе у кошек
А Высокая рекомендация В настоящее время отсутствуют
В Умеренная рекомендация Мидазолам (внутривенный болюс или внутривенная инфузия с постоянной скоростью; интраназально) – Диазепам (внутривенный болюс) - Леветирацетам (внутривенно) - Фенобарбитал (внутривенно) - Дыхательные анестетики
С Низкая рекомендация Леветирацетам (орально) - Пентобарбитал (внутривенный болюс или внутривенная инфузия с постоянной скоростью) – Пропофол (внутривенный болюс или внутривенная инфузия с постоянной скоростью)
Д Не рекомендуется к применению Мидазолам (орально) – Диазепам (внутривенная инфузия с постоянной скоростью, орально, эндотрахеально)
Е Возможная рекомендация Мидазолам (интраназально, внутримышечно, ректально, буккально) – Диазепам (интраназально, внутримышечно, ректально, буккально) -Лоразепам ( внутривенно, интраназально, ректально) – Леветирацетам (внутримышечно, ректально) – Топирамат (внутривенно, орально) - Кетамин (внутривенный болюс или внутривенная инфузия с постоянной скоростью) - Декс)медетомидин (внутривенный болюс или внутривенная инфузия с постоянной скоростью, внутримышечно) – Фосфенитоин (внутривенно) - Хлорпромазин (орально) – Аллопрегнанолол (внутривенно, внутримышечно) – Магнезия (внутривенно) – Нейростимуляция
ACVIM пирамида иерархии рекомендаций противосудорожного лечения при групповых судорожных припадках у собак
А Высокая рекомендация Мидазолам (внутривенный болюс или внутривенная инфузия с постоянной скоростью) - Леветирацетам (внутривенно)
В Умеренная рекомендация Мидазолам (интраназально, внутримышечно) – Диазепам ( внутривенный болюс или внутривенная инфузия с постоянной скоростью, интраназально, ректально) - Лоразепам (внутривенно) – Леветирацетам (ректально, орально)
С Низкая рекомендация Мидазолам (буккально) – Леветирацетам (внутримышечно)
Д Не рекомендуется к применению Мидазолам (ректально; орально) – Диазепам (внутримышечно, орально)-Лоразепам (ректально)
Е Возможная рекомендация Диазепам (буккально, эндотрахеально) - Лоразепам (интраназально) – Клоназепам/Клоразепат (орально)
ACVIM пирамида иерархии рекомендаций противосудорожного лечения при групповых судорожных припадках у кошек
А Высокая рекомендация В настоящее время отсутствуют
В Умеренная рекомендация Мидазолам (внутривенный болюс или внутривенная инфузия с постоянной скоростью) – Диазепам ( внутривенный болюс) – Леветирацетам (внутривенно, орально)
С Низкая рекомендация В настоящее время отсутствуют
Д Не рекомендуется к применению Мидазолам (орально) – Диазепам (внутривенная инфузия с постоянной скоростью, эндотрахеально, орально)
Е Возможная рекомендация Мидазолам (интраназально, внутримышечно, ректально, буккально) – Диазепам (интраназально, внутримышечно, ректально, буккально) -Лоразепам ( внутривенно, интраназально, ректально) – Леветирацетам (внутримышечно, ректально) - Клоназепам/Клоразепат (орально)
5 Конкретные рекомендации по лечению эпилептического статуса
Несмотря на то, что большинство исследований и клиницистов сосредоточены на фармакотерапии эпилептического статуса, подход к неотложной неврологической помощи также включает поддерживающее лечение и тщательный поиск причины, которые одинаково важны для прекращения приступов и обеспечения дальнейшей нейропротекции. Таким образом, устранение осложнений (например, гипертермии, метаболических нарушений, гипоксемии) и первопричины судорог (например, гипогликемия, электролитный дисбаланс) имеет жизненно важное значение для успешного исхода. Такие меры должны быть начаты на ранних стадиях заболевания, параллельно с лечением противосудорожными препаратами.
6 Лечение первой линии
6.1 Какие препараты первой линии используются для лечения эпилептического статуса вне стационара и в стационарных условиях?
Внутривенное введение в стационаре и интраназальное введение вне стационара и в стационарных условиях в настоящее время считаются наиболее эффективными и безопасными методами применения бензодиазепинов.
Лечение вне стационара:
- Интраназально мидазолам у собак (рекомендация ACVIM A) или кошек (рекомендация ACVIM E).
- Ректально диазепам у собак (рекомендация ACVIM C) или кошек (рекомендация ACVIM E).
- Внутримышечно мидазолам у собак (рекомендация ACVIM B) или кошек (рекомендация ACVIM E); этот вариант можно использовать во внебольничных условиях, если лица, осуществляющие уход, имеют медицинское образование.
Лечение в стационаре:
- Внутривенно мидазолам у собак (рекомендация ACVIM A) или кошек (рекомендация ACVIM B).
- Внутривенно диазепам у собак (рекомендация ACVIM A) или кошек (рекомендация ACVIM B).
- Интраназально мидазолам у собак (рекомендация ACVIM A) или кошек (рекомендация ACVIM E); интраназальный мидазолам может быть полезен для обеспечения быстрого противосудорожного эффекта, когда внутривенный доступ невозможен или пока не установлен внутривенный катетер.
- Внутримышечно мидазолам у собак (рекомендация ACVIM B) или кошек (рекомендация ACVIM E).
6.2 Обоснование
Недавний всеобъемлющий обзор, опубликованный членами экспертной группы, содержит дополнительную информацию и фактические данные о преимуществах и ограничениях различных способов применения препаратов. В общем, опыты на собаках показали, что эффективность и безопасность интраназального введения могут быть эквивалентны, а в некоторых клинических условиях даже превосходить внутривенное введение. Это более актуально, когда рассматривается вопрос о времени установки внутривенного катетера собаке, страдающей судорогами. В таких случаях, общий период времени от установления доступа для внутривенного введения до введения внутривенно бензодиазепина может быть более длительным, по сравнению с подготовкой и введением интраназального бензодиазепина. Кроме того, ректальный диазепам который был наиболее часто рекомендуемым средством для лечения эпилептического статуса в домашних условиях, вряд ли будет таким же эффективным или быстродействующим как интраназальный мидазолам для прекращения судорожной активности.
Однако, когда интраназальный мидазолам недоступен, владельцы могут выбрать ректальное введение диазепама (парентеральный препарат), поскольку в некоторых случаях он все еще может привести к благоприятным исходам. Интраназальный способ доставки лекарственных препаратов при эпилептическом статусе обеспечивает ряд преимуществ в качестве метода введения, которые были подробно проанализированы в предыдущих публикациях. Внутримышечное введение мидазолама может быть альтернативным эффективным и безопасным способом лечения эпилептического статуса,, когда внутривенный или интраназальный пути введения невозможны. Уровень доказательности, а также клинические результаты лечения и фармакокинетические характеристики бензодиазепинов и различные способы их применения приведены в дополнительных файлах 2-5.
6.3 Мидазолам или диазепам?
Хотя оба препарата являются эффективными и безопасными для лечения эпилептического статуса, у собак и кошек, мидазолам можно считать более эффективным и безопасным средством лечения эпилептического статуса, чем диазепам.
6.4 Обоснование
Несмотря на то, что существует больше ветеринарных отчетов об использовании диазепама при эпилептическом статусе, особенно у собак, данные, полученные как от людей, так и от животных, показывают, что мидазолам можно считать более сильным бензодиазепином, по сравнению с диазепамом. В одном исследовании на собаках мидазолам продемонстрировал более высокий лечебный эффект при судорогах, вызванных лидокаином, по сравнению с диазепамом. В двух клинических исследованиях на собаках было показано, что мидазолам безопасен и приводит к прекращению судорожных припадков примерно у 70% собак с эпилептическим статусом, независимо от способа введения. В ходе фармакодинамического и энцефалографического исследования на людях было обнаружено, что мидазолам примерно в 5 раз более эффективен, чем диазепам. В систематическом обзоре и мета-анализе у людей с эпилептическим статусом было установлено, что мидазолам превосходит диазепам при введении любым способом для прекращения судорожной активности.
В другом систематическом обзоре, проведенном у людей с опасными судорожными припадками, было показано, что у пациентов, получавших мидазолам по сравнению с диазепамом, время для достижения контроля судорожных припадков и частота их повторения были снижены. Кроме того, в исследовании эпилептического статуса на моделях -мышах лечение мидазоламом приводило к меньшему количеству рецидивов судорожных припадков и более слабой атрофии гиппокампа, потере нейронов, и глиозе, по сравнению с диазепамом или пентобарбиталом. В том же исследовании было показано, что мидазолам обладает сильным противоэпилептическим действием и предотвращает эпилептогенез, следовательно, он был рекомендован в качестве основного метода лечения для эпилептического статуса. Однако авторы Рекомендаций приняли во внимание тот факт, что период полувыведения и продолжительность действия мидазолама у собак могут быть короче, чем у диазепама, что в конечном итоге может потребовать введения мидазолама с постоянной скоростью для достижения устойчивого контроля над приступами.
Наконец, мидазолам приобрел большую популярность при лечении эпилептического статуса из-за его более безопасного лекарственного действия (т.е. угнетение центральной нервной системы и дыхания, вызванное мидазолам, протекает менее тяжело по сравнению с диазепамом и лоразепамом. Однако, в ходе мета-анализа у людей с эпилептическим статусом, риск развития респираторных осложнений, требующих вмешательства, было низким и сходным для обоих бензодиазепинов.
6.5 По истечении какого периода времени болюсное введение бензодиазепина следует считать эффективным? Когда следует начинать внутривенное введение бензодиазепина с постоянной скоростью введения ?
- Болюс бензодиазепина следует считать эффективным, если приступы прекращаются менее чем через 5 минут после введения и приступы не возобновляются менее чем через 10 минут после прекращения.
- Судорожная активность, которая контролируется с помощью бензодиазепинов, но рецидивирует в течение 10-60 минут, может рассматриваться как рецидивирующая эпилептический статус,.
- В случае рецидивирующего эпилептического статуса или эпилептического статуса,, который не прекращается после первого болюса, следует ввести вторую дозу бензодиазепина с интервалом не менее 2 минут.
- Если приступы сохраняются после 2-х болюсов бензодиазепина, то (i) в случае рецидива эпилептического статуса следует ввести еще один болюс бензодиазепина с последующим немедленным внутривенным введением бензодиазепина с постоянной скоростью введения и (ii) если эпилептический статус не прекращается, следует ввести последний болюс бензодиазепина с последующим проведением мероприятий второй линии.
- У собак возможны такие варианты, как мидазолам внутривенно с постоянной скоростью введения (рекомендация ACVIM A) или диазепам внутривенно с постоянной скоростью введения (рекомендация ACVIM B).
- У кошек предпочтительным методом лечения бензодиазепинами является внутривенное введение мидазолама с постоянной скоростью введения (рекомендация ACVIM B). Из соображений безопасности следует избегать внутривенного введения диазепама с постоянной скоростью введения (рекомендация ACVIM D).
6.6 Обоснование
В большинстве ветеринарных исследований, включенных в эти Согласованные рекомендации, не были четко определены клинические сроки, в течение которых лечение противосудорожными препаратами считается эффективным. Большинство текущих рекомендаций основаны на различных неофициальных отчетах или личных мнениях и не указывают четких временных рамок. Однако в 2 клинических исследованиях на собаках бензодиазепины считались эффективными, если судорожная активность прекращалась в течение 5 минут и рецидив не возникал в течение как минимум 10 минут после прекращения. Аналогичные временные рамки для других препаратов спасения, таких как кетамин и фосфенитоин, были использованы в других клинических исследованиях на собаках.
Основываясь на клинических рекомендациях и исследованиях на людях, бензодиазепины должны прекратить судорожную активность в течение 5-10 минут после введения, чтобы считаться эффективными. В соответствии с текущими клиническими данными и тем фактом, что следует избегать задержек в экстренном лечении судорожных припадков, авторы Рекомендаций сочли, что для успешного применения бензодиазепина требуется не более 5 клинических сеансов продолжительностью пять минут. Эти временные рамки также могут быть применены к другим препаратам спасения, используемым при экстренном лечении судорожных припадков.
Что касается временного интервала между первоначальными болюсами бензодиазепина, то, хотя в качестве периода ожидания после введения первого болюса перед введением второго можно рекомендовать не более 5 минут, следует избегать задержек в лечении. Поэтому авторы Рекомендаций рекомендуют сокращать интервал между введениями до 2 минут. 2-минутный интервал может быть разумным сроком ожидания между введениями, основанным на данных клинических исследований. В частности, в двух многоцентровых клинических исследованиях среднее время прекращения приступов после внутривенного введения мидазолама, диазепама и интраназального мидазолама у собак в группе собак, реагирующих на бензодиазепин ,составило 1 минуту (диапазон 0,2-5), 1,25 минуты (диапазон 0,6-4) и 0,8 минуты (диапазон, 0,1-5), соответственно. Кроме того, на основании данных фармакокинетических исследований, у большинства пациентов, участвовавших в исследованиях, максимальный период полувыведения после внутривенного введения бензодиазепина составлял менее 5 минут.
В случае рецидива эпилептического статуса после 2-х болюсов бензодиазепина рекомендуется третий болюс, за которым немедленно следует внутривенное введение бензодиазепина с постоянной скоростью введения. Многократное введение бензодиазепина не рекомендуется, особенно в случае диазепама, поскольку может произойти накопление и высокие концентрации препарата в центральной нервной системе, спинномозговой жидкости и кровотоке могут вызвать потенциально тяжелое угнетение центральной нервной системы и кардиореспираторной системы. Как упоминалось ранее, мидазолам можно считать более мощным и безопасным бензодиазепином, по сравнению с диазепамом. Диазепам может представлять определенный риск при внутривенном введении с постоянной скоростью введения, поскольку диазепам может адсорбироваться на пластике, что приводит к потере эффективности препарата. В двух исследованиях концентрация диазепама снижалась на 55% через 2 часа и на 70% через 24 часа хранения в пластиковых пакетах и линиях для инфузий. В другом исследовании сообщалось, что >24% эффективности диазепам терялось после хранения в пластиковом материале. Поэтому диазепам не следует хранить в пластиковых шприцах или инфузионных линиях в течение длительного времени; перед применением внутривенно с постоянной скоростью введения необходимо предварительное покрытие инфузионных линий диазепама.
Диазепам также чувствителен к свету, и поэтому при введении диазепама внутривенно с постоянной скоростью введения инфузионная трубка должна быть обернута плотным материалом (например, алюминиевой фольгой). Кроме того, диазепам разводят в носителе с пропиленгликолем из-за липофильности препарата, которая может вызвать флебит и артериальную гипотензию при быстром введении (в основном это вызывает беспокойство при быстром введении неразбавленных болюсов). Токсичность пропиленгликоля особенно опасна для кошек. Такие ограничения не описаны для мидазолама. В целом, авторы Рекомендаций рекомендуют мидазолам вместо диазепама в качестве средства для внутривенного введения с постоянной скоростью введения собакам и, особенно, кошкам. Уровень доказательности, а также терапевтические клинические результаты и фармакокинетические характеристики внутривенного введения бензодиазепина с постоянной скоростью введения приведены в дополнительных файлах 2-5.
7 Лечение второй линии
- Варианты лечения препаратами второй линии включают леветирацетам, фенобарбитал и фосфенитоин.
- Леветирацетам и фенобарбитал обычно назначаются в качестве препаратов второй линии, когда лечение первой линии не приводит к прекращению приступов, однако эти препараты также могут быть назначены ранее, независимо от реакции на лечение первой линии, с целью поддержания адекватного контроля над приступами в краткосрочной и долгосрочной перспективе (особенно в случаях, когда у пациента диагностирована эпилепсия).
- Собакам и кошкам следует начинать лечение леветирацетамом внутривенно (рекомендация ACVIM B); если внутривенное введение невозможно, то можно рассмотреть возможность внутримышечного или ректального введения леветирацетама собакам (рекомендация ACVIM C) и кошкам (рекомендация ACVIM E).
- Внутривенное введение фенобарбитала также следует начинать собакам (рекомендация ACVIM A) и кошкам (рекомендация ACVIM B). При необходимости, у животных с нормальной функцией печени, не принимающих фенобарбитал, могут быть использованы схемы дозирования с нагрузкой; для животных, находящихся на длительном лечении фенобарбиталом, увеличение дозы в идеале должно быть произведено после измерения концентрации фенобарбитала в сыворотке крови.
- Внутривенное введение фосфенитоина может быть назначено собакам в качестве дополнительного противосудорожного средства (рекомендация В ACVIM) при отсутствии или неадекватном ответе на леветирацетам или фенобарбитал.
7.1 Обоснование
Фенобарбитал и леветирацетам являются двумя сильнодействующими и безопасными противоэпилептическими средствами, которые имеют многочисленные доказательства, подтверждающие их применение как при эпилепсии, так и при неотложных судорожных расстройствах у собак и кошек, Хотя эти противоэпилептические средства считаются препаратами второй линии, клиницистам также следует рассмотреть возможность их более раннего применения (например, одновременно или после повторных болюсов бензодиазепинов и внутривенного введения с постоянной скоростью) у животных, поступающих в больницу в неотложных случаях с судорожными припадками в рамках ранней одновременной политерапии (см. также дополнительный файл 6). Такое решение может принести двукратную пользу: (i) повышенная вероятность более раннего прекращения приступов и, таким образом, предотвращения рефрактерных стадий эпилепсии, и (ii) более раннее внедрение более эффективного долгосрочного плана лечения приступов, в частности, для животных с диагнозом эпилепсия.
Кроме того, фенобарбитал, леветирацетам и фосфенитоин могут обеспечить дополнительные преимущества для преодоления терапевтических (патофизиологических) препятствий, возникающих при эпилептическом статусе (т.е. воздействуя на другие субъединицы гамма-аминомасляной кислоты А [GABAA] и внесинаптические GABAA), а также проявляя многочисленные механизмы действия, такие как воздействие на рецепторы N-метил-D-аспартата [NMDA] или α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты [AMPA], пресинаптическое высвобождение глутамата и потенциалзависимые натриевые и кальциевые каналы [см. Дополнительный файл 6]). Уровень доказательности, а также клинические результаты лечения и фармакокинетические характеристики фенобарбитала, леветирацетама и фосфенитоина, а также различные способы их введения приведены в дополнительных файлах 2-5.
8 Лечение третьей линии
Лечение третьей линии относится к анестезирующим препаратам, используемым для контроля судорожной активности. Когда эта стадия достигнута, можно перейти к четырехэтапному подходу.
- Первый шаг:
Собакам (рекомендация ACVIM A) и кошкам (рекомендация ACVIM E) следует вводить кетамин внутривенно болюсно, возможно, с последующим введением внутривенно с постоянной скоростью.
Собакам (рекомендация ACVIM B) и кошкам (рекомендация ACVIM E) следует вводить внутривенно болюсно или внутривенно с постоянной скоростью дексмедетомидин, если после введения кетамина сохраняется эпилептический статус (или наоборот).
- Второй шаг:
Собакам следует вводить пропофол внутривенно болюсно, возможно, с последующим внутривенным введением с постоянной скоростью (рекомендация ACVIM A), если эпилептический статус сохраняется после внутривенного введения кетамина и дексмедетомидина.
Кошкам следует соблюдать осторожность при повторных болюсных введениях пропофола и, особенно, при внутривенном введении с постоянной скоростью введения (рекомендация ACVIM C), из соображений безопасности; пропофол следует вводить под тщательным контролем клинических и гематологических показателей и предпочтительно только после того, как другие анестетики не смогут остановить эпилептический статус; следует предпринять усилия для ограничения продолжительности внутривенного введения пропофола с постоянной скоростью у кошек к минимуму, необходимому для достижения устойчивого контроля над судорожными припадками.
- Третий шаг:
Анестезирующие барбитураты (пентобарбитал или тиопентал натрия) могут вводиться внутривенно болюсно или внутривенно с постоянной скоростью у собак (рекомендация ACVIM B) и кошек (рекомендация ACVIM C), если эпилептический статус сохраняется после внутривенного введения пропофола.
- Четвертый шаг:
Собакам и кошкам следует начинать ингаляционную анестезию (рекомендация ACVIM B), если после предыдущих вмешательств эпилептический статус сохраняется.
8.1 Обоснование
Анестетики являются препаратами выбора для людей и животных с рефрактерным эпилептическим статусом, который не удалось купировать после предыдущего комбинированного лечения. Рекомендуемыми препаратами являются кетамин, дексмедетомидин, пропофол, барбитураты (тиопентал или пентобарбитал) и ингаляционные анестетики. У людей и животных нет сравнительных доказательств (i) превосходства одного конкретного анестетика над другим, (ii) комбинированных стратегий, (iii) точной продолжительности внутривенного введения с постоянной скоростью и (iv) порядка, в котором следует вводить рекомендуемые препараты. Поскольку применение общих анестетиков, в частности барбитуратов, а затем пропофола и ингаляционных анестетиков, может быть связано с проблемами безопасности и более высокой частотой осложнений в стационаре, рационально сначала попытаться контролировать рефрактерный эпилептический статус, назначая препараты с более высоким профилем безопасности, то есть дексмедетомидин и кетамин. Если дексмедетомидин недоступен, в качестве альтернативы можно использовать медетомидин, хотя клинических доказательств его применения при лечении эпилептического статуса меньше.
Поэтому авторы Рекомендаций рекомендуют вводить внутривенно болюсно и внутривенно с постоянной скоростью дексмедетомидин, а в случае неудачи можно начать внутривенное введение кетамина болюсно или с постоянной скоростью и наоборот. Назначение кетамина в более ранние сроки (т.е. после прогрессирования или установления резистентности к бензодиазепинам или во время II стадии) непосредственно перед лечением препаратами второй линии или в сочетании с ними также может рассматриваться как часть ранней одновременной политерапии. Преимущества и соображения, а также подтверждающие факты, касающиеся этого подхода, представлены в дополнительном файле 6. Когда кетамин и дексмедетомидин не помогают контролировать рефрактерный эпилептический статус, в терапевтический подход могут быть включены анестетики, такие как пропофол внутривенно болюсно и с постоянной скоростью инфузии, затем барбитураты внутривенно болюсно и с постоянной скоростью инфузии, и, наконец, ингаляционные анестетики.
Дексмедетомидин является агонистом α2-адренорецепторов, который действует путем уменьшения количества возбуждающих нейромедиаторов через супрессию симпатической нервной системы и высвобождения норадреналина, главным образом в областях миндалевидного тела, гиппокампа и коры головного мозга. Кроме того, дексмедетомидин обладает нейропротекторными свойствами, снижая потребность мозга в метаболизме и кислороде, уменьшая отек мозга посредством сужения сосудов и содействия поддержанию нормального среднего артериального давления. В исследовании на кошках, микроинфузия агониста α2-адренорецепторов в миндалевидное тело привела к защите от индукции судорожных припадков. У крыс введение дексмедетомидина приводило к прекращению резистентного эпилептического статуса.
Дексмедетомидин также может быть полезен для уменьшения возбуждения во время восстановления. Побочные эффекты включают замедление дыхания, брадикардию, сердечные аритмии и гипотермию, однако последняя может быть полезна для мозга при длительном эпилептическом статусе. Согласно отчету о 3 собаках с идиопатической эпилепсией, у которых наблюдался сверхрезистентный эпилептический статус, комбинация кетамина-дексмедетомидина в виде внутривенной инфузии с постоянной скоростью и умеренной гипотермии (36,7-37,7°C) привела к прекращению сверхрезистентного эпилептического статуса.
Кетамин повышает кровяное давление, что может нейтрализовать неблагоприятные гемодинамические эффекты других анестетиков у людей и животных. Этот эффект был дополнительно подтвержден в клинических исследованиях на людях, когда кетамин вводили одновременно с пропофолом (комбинация, известная как кетофол). Кетофол может приводить к улучшению гемодинамики и дыхательной функции по сравнению с одним только пропофолом. В клиническом исследовании на людях с рефрактерным эпилептическим статусом кетофол успешно купировал судорожную активность. В том же исследовании сообщалось, что кратковременная или длительная инфузия кетамина, с введением пропофола или без него, также была эффективна в борьбе со сверхрезистентным эпилептическим статусом. Подробности об использовании кетамина при эпилептическом статусе приведены в дополнительном файле 6.
Пропофол воздействует на GABAA рецепторы ( агонист), а также может взаимодействовать с рецепторами глицина (агонист) и NMDA (антагонист), а также с кальциевыми каналами. Побочные эффекты включают угнетение сердечно-сосудистой системы и дыхания, боль в месте инъекции и потерю рвотного рефлекса. Эндотрахеальная интубация должна проводиться при введении пропофола. Обычно в состав пропофола входит 2%-ный бензиловый спирт, но этот препарат не маркирован для применения в клинических условиях, поскольку он может вызывать неблагоприятные неврологические или сердечно-сосудистые эффекты. Однако в ходе исследования на кошках не было обнаружено существенных различий между животными, получавшими несколько болюсов пропофола в дозе до 24 мг/кг с 2%-ным бензиловым спиртом или без него.
Пропофол внутривенно с постоянной скоростью инфузии или многократные болюсы у кошек могут вызывать побочные эффекты, такие как анемия Хайнца. Большинство этих исследований показали, что анемия не имеет клинического значения. Однако в двух исследованиях симптомы были клинически значимыми. В одном исследовании также сообщалось о недомогании, анорексии, диарее, отеке морды и увеличении времени восстановления. На основании этих исследований на кошках общая накопленная доза, а также продолжительность приема пропофола могут быть важными факторами для побочных эффектов, связанных с приемом пропофола. Однако ни в одном из этих исследований не проводилось долгосрочного наблюдения и точная продолжительность лечения пропофолом, ответственная за появление клинически значимых симптомов, не была четко определена. В одном исследовании 30-минутное внутривенная инфузия пропофола с постоянной скоростью в течение 5-7 дней подряд вызывало у здоровых кошек появление телец Хайнца, повышение массы тела, клинические проявления заболевания и увеличение времени выздоровления, а клинические признаки исчезали в течение 1-2 дней после прекращения приема пропофола.
В другом исследовании общая доза пропофола превышавшая 40 мг/кг в течение всего периода лечения, возможно, была фактором, способствующим формированию телец Хайнца. В том же исследовании прекращение приема пропофола привело к исчезновению анемии в течение 4-7 дней. Кроме того, сообщалось о синдроме инфузии пропофола (сердечная дисфункция, гиперкалиемия, рабдомиолиз и ацидоз), сопровождающемся высокой заболеваемостью и смертностью после длительной анестезии у людей. Однако, подобная ситуация не получила широкого распространения в ветеринарии, за исключением случая, когда у собаки был описан синдром, похожий на синдром инфузии пропофола, с рабдомиолизом, миоглобинурией, нарушениями сердечного ритма, повышением активности печеночных ферментов и метгемоглобинемией после анестезии пропофолом.
Наконец, сообщалось о возникновении судорожных припадков при введении пропофола людям и животным, что, вероятно, связано с антагонизмом глицина на уровне спинного мозга. Такая ситуация обычно возникает после введения анестетика из-за изменения концентрации пропофола в сыворотке крови. В целом, группа экспертов рекомендует использовать пропофол внутривенно болюсно и в виде инфузии с постоянной скоростью у животных с эпилептическим статусом. Однако у кошек его следует применять осторожно, под тщательным наблюдением и предпочтительно только после того, как другие анестетики не смогли купировать рефрактерный эпилептический статус.
9 Что делать, если комплексные меры, включающие лечение первой, второй и третьей линии, а также поддерживающую терапию, по – прежнему не приводят к прекращению судорожной активности?
- Собакам и кошкам могут быть рекомендованы другие фармакологические вмешательства (рекомендация E ACVIM), включая, но не ограничиваясь этим, внутривенное введение магния и аллопрегнанолона.
- Если эти фармакологические методы лечения не помогают, могут быть рассмотрены немедикаментозные методы (например, нейростимуляция у собак и кошек; рекомендация E ACVIM).
9.1 Обоснование
У животных, которые невосприимчивы ко всем методам лечения, у которых судороги сохраняются либо во время анестезии, либо повторяются сразу после отмены общей анестезии, состояние прогрессирует до стадии супер-невосприимчивости. Продолжение интенсивной терапии, мониторинг и все ранее назначенные лекарственные препараты важны, но необходимы дополнительные фармакологические и немедикаментозные вмешательства. Даже в медицине человека ограниченные данные подтверждают такие вмешательства. В ветеринарной медицине фактические данные и клинический опыт ограничены или отсутствуют. Фармакологические вмешательства, такие как внутривенное введение магнезии и аллопрегнанолона, а также умеренная гипотермия, могут обеспечить дополнительный противоотечный эффект у собак и кошек со сверхрезистентным эпилептическим статусом.
Магний может ингибировать NMDA-рецепторы и кальциевые каналы и усиливать мозговой кровоток за счет расширения сосудов. Согласно описанию случая с собакой, внутривенное введение магния может быть полезным после терапии третьей линии68. Аллопрегнанолон может воздействовать на синаптические и, главным образом, внесинаптические GABAA рецепторы. Два фармакокинетических исследования на собаках показали благоприятный фармакокинетический профиль и профиль безопасности аллопрегнанолона при эпилептическом статусе. Гипотермия снижает уровень возбуждающих нейромедиаторов., кальций - и -глютамат -индуцируемую эксайтотоксичность, и скорость мозгового метаболизма, и нормализует внутричерепное давление. Согласно клиническому исследованию, проведенному у собак, умеренная гипотермия (36,7-37,7°C) в сочетании с внутривенной инфузией с постоянной скоростью кетамина-дексмедетомидина была эффективной для прекращения суперрезистентного эпилептического статуса.
Появляющиеся данные свидетельствуют о том, что системное воспаление (например, активация сигнальных путей, включая toll-подобный рецептор-сигнальную сеть рецепторов интерлейкина [IL] 1 и повышенные концентрации маркеров воспаления, таких как IL-1B, IL-6 и фактор некроза опухоли альфа [TNF-a]), могут играть определенную роль в запуске и поддержание судорожной активности. Клинические исследования и рекомендации у людей показывают, что иммуномодулирующее лечение, такое как кортикостероиды, может принести пользу на всех стадиях и, в частности, на суперрезистентных стадиях эпилептического статуса.. В дополнение к их иммуносупрессивному эффекту, кортикостероиды также могут снижать проницаемость гематоэнцефалического барьера и положительно регулировать транспортеры, таких как Р-гликопротеин, которые могут способствовать стойкому и невосприимчивому к лекарственным препаратам эпилептическому статусу.
Кортикостероиды могут оказывать положительное влияние на отек мозга и внутричерепное давление. В ветеринарной медицине отсутствуют клинические исследования по применению иммуномодулирующих средств в случаях суперрезистентного эпилептического статуса и клинический опыт в таких случаях ограничен. Поэтому авторы Рекомендаций не проводили дальнейшей оценки и не давали конкретных рекомендаций, хотя в настоящее время нельзя полностью игнорировать возможность того, что иммуномодулирующие препараты приносят пользу в таких случаях.
Наконец, если все фармакологические вмешательства окажутся безуспешными, нейростимуляция, такая как стимуляция блуждающего нерва, повторяющаяся транскраниальная магнитная стимуляция и глубокая стимуляция мозга, может послужить последним средством для прекращения эпилептического статуса. Хотя применение нейростимуляции при суперрезистентном эпилептическом статусе у людей все еще находится в стадии разработки, текущие данные клинических исследований показали, что нейростимуляция может купировать судороги у ≥80% пациентов. В ветеринарии нейростимуляция, такая как транскраниальная магнитная стимуляция и, в частности, стимуляция блуждающего нерва, изучалась только клинически при лечении лекарственно-устойчивой эпилепсии у собак.
Глубокая стимуляция мозга была оценена у собаки с лекарственно-устойчивой идиопатической эпилепсией и показала, что она может предотвратить эпилептический статус в течение длительного периода времени – около 7 месяцев, но ее эффект во время эпилептического статуса не оценивался. Уровень доказательности, а также клинические результаты лечения и фармакокинетические характеристики (если применимо) этих вмешательств приведены в дополнительных файлах 2-5.
10 Когда следует прекратить прием дополнительных противосудорожных препаратов ?
- Если в течение 24-48 часов после добавления препарата или последней корректировки дозы препаратов судорог больше не возникает, то далее в препаратах для анестезии нет необходимости.
- Все применяемые в настоящее время препараты для анестезии следует продолжать в дозировках, обеспечивающих прекращение судорожных припадков, в течение 24-48 часов после прекращения припадков, но также можно использовать более короткие сроки (например, 12 часов) для снижения риска осложнений, связанных с длительной госпитализацией и прекращением приема анестетиков.
- Электроэнцефалография в сочетании с клиническим подтверждением прекращения приступов предпочтительнее, чем только клиническое подтверждение, особенно в случае неконвульсивного эпилептического статуса.
10.1 Обоснование
Постоянный мониторинг электроэнцефалографии может помочь в определении направления лечения, снижении дозы лекарственных препаратов, выявлении рецидива и предотвращения недостаточного или чрезмерного лечения. У людей лечение обычно определяется результатами электроэнцефалографии и подтверждается клинической оценкой. У пациентов, находящихся в коматозном состоянии, или у тех, кто страдает от неконвульсивного эпилептического статуса, электроэнцефалография имеет жизненно важное значение для оценки прекращения приступов. Целью является прекращение выявления на электроэнцефалографии судорог или вспышек электрической активности, а также отсутствие клинических проявлений судорог. Анестезирующее лечение следует подбирать таким образом, чтобы оно подавляло вспышки электрической активности, ориентируясь на интервал между вспышками электрической активности, составляющий приблизительно 10 секунд, по крайней мере, в течение 24 часов. Однако не была установлена связь между конкретным интервалом между вспышками электрической активности и исходом.
Пациентам не обязательно требуется титрование внутривенных анестетиков для достижения 10-секундных интервалов между вспышками электрической активности на электроэнцефалографии, что может позволить снизить дозы внутривенных анестетиков и привести к меньшему количеству побочных эффектов. Исход может не зависеть от конкретного используемого анестетика и степени подавления вспышек электрической активности на электроэнцефалографии. За исключением интервала между вспышками электрической активности, другими характеристиками электроэнцефалографии, которые связаны с успешным лечением при эпилептическом статусе, являются вспышки электрической активности без мономорфных острых волн или высокой амплитуды, а также записи с эпилептиформной активностью менее чем в 50% вспышек. Повторение приступов может быть более вероятным после “сильно эпилептиформных вспышек” (с острыми волнами или ритмичной, потенциально иктальной активностью более чем в 50% случаев), чем после полиморфных вспышек активности. Эти характеристики электроэнцефалография могут помочь врачам адаптировать лечение к менее агрессивной анестезиологической политерапии у пациентов-людей, даже если интервалы между вспышками электрической активности составляют менее 10 секунд. В целом, рекомендации для людей традиционно рекомендуют продолжать инфузию анестетиков в течение 24-48 часов с последующим постепенным уменьшением дозы.
Хотя терапевтическая кома, вызванная с помощью анестетиков, обычно необходима в случаях рефрактерного эпилептического статуса для прекращения приступов, нет убедительных доказательств того, что терапевтическая кома однозначно снижает смертность. У пациентов с эпилептическим статусом, находящихся в терапевтической анестезиологической коме, риск инфицирования и смертности может быть выше, чем у пациентов, не получающих анестетики. Было выявлено, что применение внутривенных анестетиков приводит к неблагоприятным исходам, искусственной вентиляции легких и сердечно-сосудистым осложнениям. Более высокие дозы внутривенных анестетиков были связаны с более высокой частотой артериальной гипотензии и применения вазопрессоров, по сравнению с более низкими дозами. В систематическом обзоре медицинской литературы для людей, хотя внутривенное введение пентобарбитала было связано с меньшей частотой кратковременных неудач лечения и рецидивов эпилептического статуса, наблюдалась более высокая частота артериальной гипотензии по сравнению с внутривенным введением мидазолама или пропофола.
В целом, хотя идеальной рекомендацией было бы введение анестетиков при помощи внутривенной инфузии с постоянной скоростью введения продолжительностью не менее 24 часов, основанной на рекомендациях, используемых у людей, авторы Рекомендаций рассмотрели минимальную продолжительность в 12 часов, которая определяется индивидуально, в зависимости от клинического состояния животного и с целью снижения рисков, связанных с длительной госпитализацией и побочными эффектами лекарственных препаратов. Однако в недавнем исследовании на собаках не было обнаружено превосходства более короткой (12 часов), по сравнению с более длительной (24 часа) продолжительностью приема пропофола или диазепама при помощи внутривенной инфузии с постоянной скоростью введения в отношении исхода или продолжительности госпитализации. Авторы Рекомендаций предполагают, что если приступы возобновляются в течение 12-часового периода внутривенного введения анестетика, то у клинически стабильных пациентов следует рассмотреть возможность более длительного введения анестетика.
В целом, важно использовать адекватные инструменты для оценки прекращения судорожных припадков, чтобы избежать чрезмерного применения внутривенных анестетиков. В ветеринарии, хотя электроэнцефалография является идеальным инструментом для коррекции лечения, она не является широко доступной, а широкий клинический опыт отсутствует. Об электроэнцефалографии как инструменте при лечении эпилептического статуса у собак и кошек сообщалось лишь в небольшом количестве клинических исследований. В большинстве клинических исследований, оцененных для этих Согласованных рекомендаций, критерии, используемые для подбора лечения при эпилептическом статусе, были в основном клиническими (т.е. прекращение симптомов, связанных с приступами). Однако клинические критерии могут быть недостаточно чувствительными или специфичными для определения прекращения приступов, что еще более важно в случае неконвульсивного эпилептического статуса.
Нелеченный неконвульсивный эпилептический статус увеличивает риск эксайтотоксического повреждения нейронов и осложнений и эпилептический статус может стать более резистентным к лекарствам. При отсутствии электроэнцефалография врачи рискуют не только недополучить, но и перелечить, вводя чрезмерные дозы нескольких внутривенных анестетиков в течение длительного периода времени. Длительная терапевтическая кома может привести к тяжелому угнетению дыхания и сердечно-сосудистой системы, которое со временем может прогрессировать. Таким образом, хотя ветеринарные врачи по-прежнему могут полагаться на клиническое прекращение судорожной активности, комиссия рекомендует использовать электроэнцефалографию, когда это возможно, для определения успешных результатов и соответствующих индивидуальных планов лечения.
11 Если эпилептический статус прекращен, как мне следует уменьшать обьем лечения?
- Перед началом уменьшения обьема лечения рекомендуется, чтобы у животных не было судорог в течение 24-48 часов (минимум 12 часов).
- После прекращения эпилептического статуса, в идеале, следует постепенно прекратить прием анестетиков в течение 24-48 часов; также могут быть рассмотрены более короткие периоды, например, 12 часов.
- Не рекомендуется одновременное уменьшение дозы >1 анестетика.
- Сначала можно отменить ингаляционные анестетики, затем пропофол или пентобарбитал, затем кетамин и, наконец, дексмедетомидин и бензодиазепин (т.е., как правило, в обратном порядке, в котором они вводились), но порядок отмены может варьироваться в зависимости от мнения врача.
- Введение ингаляционных анестетиков может быть уменьшено или отменено быстрее, по сравнению с внутривенными анестетиками.
- Внутривенная инфузия с постоянной скоростью введения может уменьшаться в дозировании на 25-50% каждые 4-6 часов перед прекращением приема препарата; если нет рецидива эпилептического статуса, то дозу следующего препарата, вводимого с помощью внутривенной инфузии с постоянной скоростью можно снизить таким же образом.
- Если после прекращения приема определенного анестетика судорожная активность возобновляется, то дозу препарата, вводимого с помощью внутривенной инфузии с постоянной скоростью следует увеличить до предыдущей дозы, которая была достаточной для контроля приступов (в тех случаях, когда приступы возобновлялись при снижении дозы), или повторно начать после болюсного введения препарат, вводимый с помощью внутривенной инфузии с постоянной скоростью, в тех случаях, когда приступы возобновлялись после полной отмены препарата.
- Неанестезирующие препараты (например, леветирацетам или фенобарбитал) следует вводить как минимум до выписки животного из госпиталя (в случаях с реактивными припадками) или в течение длительного времени (в случаях с диагнозом эпилепсия), используя постоянные дозы и, при необходимости, целевые концентрации препаратов в сыворотке крови.
11.1 Обоснование
В медицине и ветеринарии накапливаются данные, подтверждающие необходимость применения оперативного подхода к лечению для улучшения результатов при эпилептическом статусе. Однако отсутствуют убедительные доказательства применения стандартизированной схемы лечения, касающейся процесса отмены терапевтических средств, ранее применявшихся для прекращения эпилептического статуса. После успешного купирования эпилептического статуса следует прекратить прием сильнодействующих седативных препаратов для анестезии, чтобы избежать серьезных побочных эффектов и осложнений, связанных с анестезирующими препаратами и длительными периодами госпитализации. Однако стратегия отмены должна быть достаточно тщательной, чтобы предотвратить рецидив эпилептического статуса. Таким образом, рациональным подходом было бы осторожное, постепенное, последовательное прекращение приема анестетиков.
У людей, как упоминалось ранее, схема лечения обычно определяется данными электроэнцефалографии и подтверждается клинической оценкой. Как только на основе электроэнцефалографии достигнуто клиническое прекращение эпилептического статуса, можно начинать ее отмену. В частности, в рекомендациях по применению у людей традиционно рекомендуется продолжать инфузию анестетика в течение 24-48 часов после прекращения приступов, а затем постепенно снижать дозу в течение 24 часов до прекращения приема Одновременное снижение дозы двух анестетиков не рекомендуется, поскольку это может привести к увеличению риска рецидива приступов и ухудшению состояния пациента. Это не позволяет клиницисту оценить, какое средство является эффективным или нуждается в продолжении применения.
При уменьшении дозы или отмене терапевтического средства у пациентов может возникнуть рецидив эпилептического статуса, что потребует возврата к предыдущим или более высоким дозам этого препарата для дополнительного цикла анестезии (обычно 24-48 часов), прежде чем возобновить снижение дозы, с добавлением другого средства или без него. Также могут возникать повторяющиеся изолированные судорожные припадки при отмене препарата и, как правило, они требуют лечения. Однако, возможно, лучше перетерпеть единичные судорожные припадки ,выявленные при помощи электроэнцефалографии, или даже клинические припадки, особенно если они кратковременные и нечастые, чем держать пациентов в отделении интенсивной терапии еще несколько дней для проведения дополнительного агрессивного лечения.
Важным фактором при ведении пациентов с эпилептическим статусом является балансирование риска клинического рецидива судорог с риском более длительной госпитализации в отделение интенсивной терапии и связанных с этим осложнений. В целом, нет ограничений по времени или количеству циклов общей анестезии. Хотя целью всегда должно оставаться прекращение эпилептического статуса, ограничение сводится к определению того, в какой момент терапевтическая цель должна измениться с полного контроля над приступами на принятие определенной частоты изолированных судорожных припадков у пациента.
В ветеринарной медицине, несмотря на отсутствие стандартизированных рекомендаций или исследований, специально оценивающих стратегию прекращения приема анестетиков, используемых при эпилептическом статусе, было бы рационально придерживаться подхода, аналогичного рекомендациям, используемым для лечения пациентов-людей. Основываясь на клиническом опыте и расширенных протоколах применения у людей, рекомендуется снижать дозу препарата, вводимого при помощи внутривенной инфузии с постоянной скоростью на 25-50% каждые 4-6 часов перед отменой конкретного лекарственного средства. Авторы Рекомендаций поддерживают эту схему и рекомендует постепенное снижение дозы анестетиков. Снижение дозы каждого отдельного анестетика предпочтительно проводить в течение 12-48 часов в порядке, обратном началу. Не рекомендуется быстрое снижение дозы или одновременная отмена нескольких анестетиков.
12 Руководства и рекомендации по лечению групповых судорожных припадков
Надлежащий контроль групповых судорожных припадков состоит из долгосрочного и краткосрочного планов (Изобр 6). Долгосрочное лечение направлено главным образом на профилактику групповых судорожных припадков и достигается при соответствующем проведении противоэпилептического лечения эпилепсии (т.е. оптимизации, мониторинге и корректировке доз и терапевтических схем долгосрочных поддерживающих препаратов, таких как фенобарбитал, бромид калия, зонисамид, леветирацетам). Долгосрочное лечение было описано в других Согласованных рекомендациях и систематических обзорах. Поскольку, в данных Согласованных рекомендациях основное внимание уделяется неотложным судорожным расстройствам, а не долгосрочному лечению эпилепсии у собак и кошек, рассматривается только краткосрочное неотложное лечение групповых судорожных припадков. Краткосрочное лечение включает в себя введение препаратов короткого действия (мидазолам и диазепам) и препаратов длительного действия (леветирацетам). Если препараты короткого и длительного действия не помогают контролировать групповые судорожные припадки, то к краткосрочному плану могут быть добавлены дополнительные мероприятия, включая препараты длительного действия (например, клоназепам и клоразепам) или дополнительные дозы препаратов длительного действия, таких как фенобарбитал (для пациентов с диагнозом эпилепсия). Как и в случае с эпилептическим статусом, поддерживающее лечение и устранение любых системных осложнений или основной этиологии имеют жизненно важное значение для достижения успешных результатов и должны сочетаться с применением противосудорожных лекарственных препаратов.
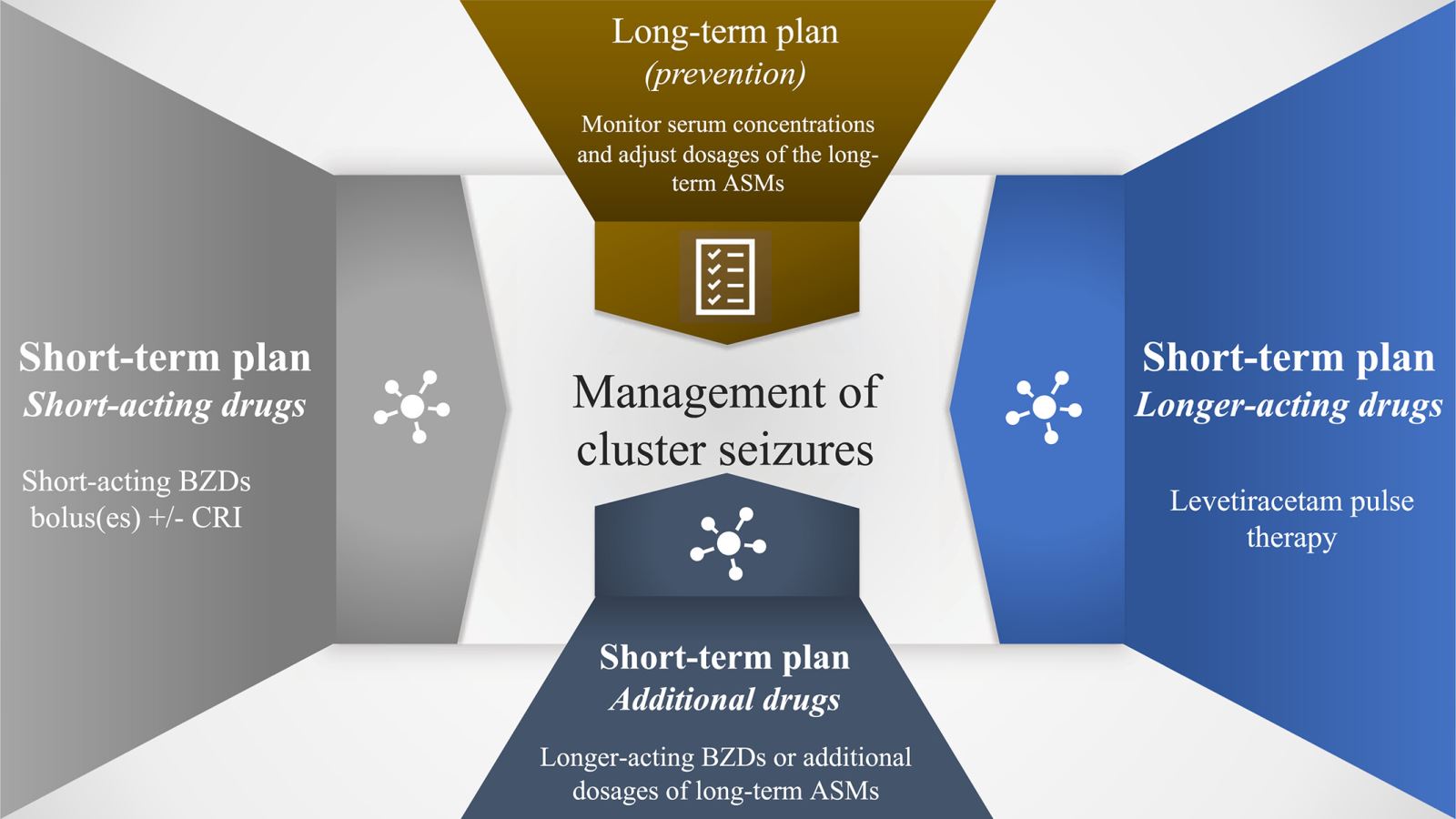
Изобр 6. Долгосрочный и краткосрочный план лечения групповых судорожных припадков у собак и кошек.
В целом, можно придерживаться трехэтапного краткосрочного плана:
Первый шаг:
Лечение вне стационара:
Препараты короткого действия:
- Мидазолам интраназально у собак (рекомендация ACVIM B) или кошек (рекомендация ACVIM E).
- Диазепам ректально у собак (рекомендация ACVIM B) или кошек (рекомендация ACVIM E).
Препарат более длительного действия:
- Леветирацетам назначают внутривенно собакам (рекомендация ACVIM B) или кошкам (рекомендация ACVIM B); если внутривенное введение невозможно (например, из-за сильно сниженного уровня сознания или неспособности глотать), леветирацетам можно назначать внутривенно собакам (рекомендация ACVIM B) или кошкам (рекомендация ACVIM E); Внутримышечно леветирацетам также можно назначать собакам (рекомендация ACVIM C) или кошкам (рекомендация ACVIM E), но этот вариант можно использовать и вне стационара, если лица, осуществляющие уход, имеют медицинскую подготовку
В условиях стационара:
Препараты короткого действия:
- Мидазолам внутривенно у собак (рекомендация ACVIM A) или кошек (рекомендация ACVIM B).
- Диазепам внутривенно у собак (рекомендация ACVIM B).
- Мидазолам интраназально у собак (рекомендация ACVIM B) или кошек (рекомендация ACVIM E); интраназальный мидазолам может быть более полезен для обеспечения быстрого противосудорожного эффекта, когда внутривенный доступ невозможен или пока не установлен внутривенный катетер.
- Мидазолам внтримышечно у собак (рекомендация ACVIM B) или кошек (рекомендация ACVIM E).
- Если после последних болюсов бензодиазепина наблюдается рецидив судорог, следует ввести еще один болюс, за которым немедленно следует внутривенная инфузия с постоянной скоростью мидазолама собакам (рекомендация ACVIM A) или кошкам (рекомендация ACVIM B); в качестве альтернативы, только собакам, ввести еще один болюс диазепама, за которым немедленно следует внутривенная инфузия с постоянной скоростью диазепама( рекомендация ACVIM B), если мидазолам недоступен.
Препарат более длительного действия:
- Леветирацетам, в виде внутривенной пульс – терапии собакам (рекомендация ACVIM A) или кошкам (рекомендация ACVIM B); если внутривенное введение невозможно, леветирацетам может назначаться ректально собакам (рекомендация ACVIM B) или кошкам (рекомендация ACVIM E) или внутримышечно собакам (рекомендация ACVIM C) или кошкам (рекомендация ACVIM E).
Второй шаг:
Если групповые судорожные припадки сохраняются, несмотря на комбинированное лечение леветирацетамом и бензодиазепином короткого действия, есть еще 2 варианта лечения:
- Препараты длительного действия (например, клоназепам или клоразепат) можно вводить собакам и кошкам внутривенно в качестве импульсной терапии каждые 8-12 часов (особенно в условиях стационара) (рекомендация E ACVIM); однако кошкам следует проявлять осторожность из-за потенциальных опасений по поводу безопасности (например, гепатотоксичности).
или
- Собакам и кошкам могут быть назначены дополнительные дозы противосудорожных препаратов, используемых для длительного лечения эпилепсии, таких как фенобарбитал.
Третий шаг:
Если после вышеупомянутой политерапии групповые судорожные припадки все еще сохраняются, следует начать дальнейшие вмешательства, как показано для случаев (III стадии) эпилептического статуса.
12.1 Обоснование
При возникновении групповых судорожных припадков может быть начат краткосрочный план лечения во время или сразу после первого приступа (если известно, что у животного во время приступов наблюдаются групповые судорожные припадки.) или, чаще всего, во время или после второго приступа; цель состоит в том, чтобы прекратить приступы и предотвратить дальнейшие приступы в краткосрочной перспективе. Если частота изолированных приступов увеличивается или групповые судорожные припадки не поддаются краткосрочному лечению, следует назначить дополнительную терапию противосудорожными препаратами таким же образом, как и при эпилептическом статусе. Таким образом, принципы, описанные для лечения эпилептического статуса, могут применяться и при групповых судорожных припадках.
В дополнение к бензодиазепинам авторы Рекомендаций рекомендовали препараты длительного действия (например, леветирацетам) в качестве эффективного и безопасного средства. Вместо длительного непрерывного лечения было рекомендовано импульсное лечение, поскольку оно может предотвратить развитие толерантности, связанной с постоянным применением препарата. В амбулаторных условиях леветирацетам может быть использован в качестве средства первого выбора. Ректальное введение также может быть использовано у собак, особенно когда пероральное введение невозможно. Собакам, которые постоянно получают лечение фенобарбиталом, может потребоваться более высокая доза леветирацетама. Несмотря на отсутствие клинических исследований, оценивающих применение импульсного лечения леветирацетамом у кошек при групповых судорожных припадках, авторы Рекомендаций рекомендуют его применение, основываясь на доказанной эффективности и безопасности леветирацетама при эпилепсии и клиническом опыте специалистов.
В условиях стационара внутривенное введение мидазолама, в частности, следует применять как собакам, так и кошкам в качестве первого варианта. Внутривенное введение диазепама также может применяться у собак, только если мидазолам не является возможным вариантом; у кошек это не рекомендуется из соображений безопасности, о чем говорилось выше. Внутривенное введение бензодиазепина в виде инфузии с постоянной скоростью, в частности мидазолама, может быть начато в случае рецидива судорог с целью достижения устойчивого и неизменного противоэпилептического эффекта. Собакам и кошкам леветирацетам можно вводить внутривенно, а если внутривенное введение недоступно, то можно вводить внутримышечно или ректально. Уровень доказательности, а также клинические результаты лечения и фармакокинетические характеристики бензодиазепинов и различные способы их введения приведены в дополнительных файлах 2-5.
Если групповые судорожные припадки не реагируют адекватно на вышеупомянутую комбинацию, дальнейшие меры включают в себя введение бензодиазепинов длительного действия (клоназепам или клоразепат; только для собак) или дополнительных доз противосудорожных препаратов длительного действия (собакам и кошкам). Что касается последнего, то в случаях, когда у пациента диагностирована эпилепсия, такие противоэпилептические препараты, как фенобарбитал, можно вводить внутривенно или внутримышечно после каждого изолированного приступа с интервалом не менее 1 часа и не более 3 раз в течение 24 часов. Для животных с диагнозом эпилепсия, которые не находятся на длительном лечении, могут быть рассмотрены схемы дозирования фенобарбитала (собаки и кошки), бромида калия (собаки) или других лекарственных препаратов. Хотя ни в одном из исследований конкретно не оценивались эти подходы и не сообщалось о них, авторы Рекомендаций, основываясь на клиническом опыте, рассматривают их как дополнительные методы лечения у собак или кошек с групповыми судорожными припадками. Следует провести забор крови для оценки концентрации в сыворотке противосудорожных препаратов (если применимо) и соответствующим образом скорректировать дозировку.
13 Выводы
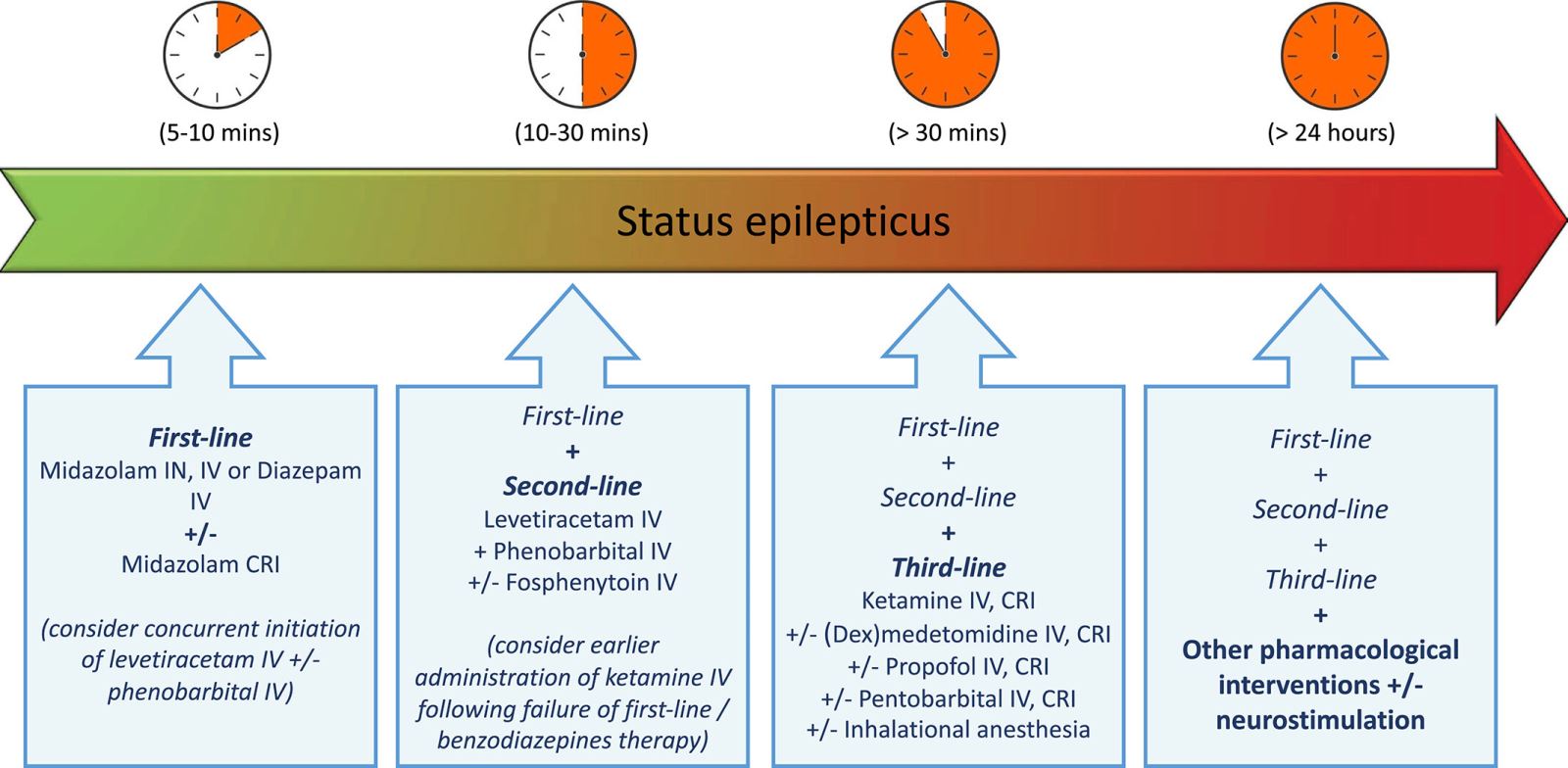
Неотложные состояния, связанные с судорожными припадками, являются сложными, со сложной патофизиологией, быстро прогрессирующей лекарственной устойчивостью и самоподдерживающимся характером. Успешное ведение включает в себя (i) поэтапный подход к лечению, включающий вмешательства с рекомендациями ACVIM от умеренного до предпочтительно высокого уровня, (ii) устранение патофизиологически обоснованных препятствий к лечению и предотвращение рефрактерных стадий путем применения раннего и быстрого терапевтического подхода, и (iii) лечение осложнений и основных причин, связанных с к экстренным случаям припадка. Терапевтический подход в ответ на стадию эпилептического статуса (изобр 7), а также алгоритмы лечения при эпилептическом статусе (Дополнительный файл 7) и групповых судорожных припадках представлены в качестве руководства по ведению экстренных случаев судорожных припадков.
 https://veter96.ru/zabolevaniya/nevrologiya/infuzii-diazepama-ili-propofol
https://veter96.ru/zabolevaniya/nevrologiya/infuzii-diazepama-ili-propofol
Изобр 7. Терапевтические подходы ACVIM при эпилептическом статусе в зависимости от стадии.
Статьи по теме:
Новая переводная статья в Телеграм
(краткое содержание)
https://t.me/veterinar66
Обыкновенная пузырчатка у собаки, предположительно, вызванная фенобарбиталом
Veterinary Record Case Reports
19 January 2026
200 видео патологических непроизвольных движений у собак и кошек с описанием.
Видео можно смотреть по платной подписке в Телеграме.
Список видео:
Часть 2: пароксизмальная дискинезия и дистония
Полезные статьи
- 70 переводных статей об эпилепсии собак и кошек
- Судорожные припадки и эпилепсия у кошек
- Судорожные припадки у собак
- Парез\паралич и слабость лап у собак и кошек
- Нарушения равновесия у собак и кошек
- Боль у собак и кошек с неврологическим заболеванием
- Симптомы при разной локализации неврологических нарушений у собак и кошек






